上转换荧光探针辅助的光学成像技术在肿瘤显影中的应用研究进展
海热古·吐逊, 郭乐, 丁嘉仪, 周嘉琪, 张学良, 努尔尼沙·阿力甫
无机材料学报
2025, 40 ( 2):
145-158.
DOI:10.15541/jim20240058
肿瘤的早期诊断是癌症高效诊疗的关键基础。可视化荧光成像技术凭借其高时间-空间分辨率、高灵敏度、无电离辐射、无创和实时成像等优点, 在生物医学领域尤其是肿瘤的早期诊断中展现出巨大应用潜力。与可见光相比, 近红外(Near-infrared, NIR)光穿透生物组织时, 其受到的吸收和散射显著减少, 这一特性使得基于NIR光的荧光成像技术在生物医学领域展现出高信噪比及高空间分辨率的独特优势, 而高质量NIR荧光成像依赖于性能卓越的荧光探针。在众多荧光探针中, NIR光激发的上转换纳米颗粒(Upconversion Nanoparticles, UCNPs)因其低毒性、窄带发射、可调发射、长荧光寿命、良好的光化学稳定性以及高量子产率等优异特性, 在荧光成像领域脱颖而出。本文总结了上转换荧光探针的基本原理、合成方法、改性与修饰技术, 重点阐述了稀土掺杂上转换荧光探针在几种典型成像模式及肿瘤多模态成像中的最新研究进展, 并对进一步实现诊疗一体化的应用研究进行了展望。
View image in article
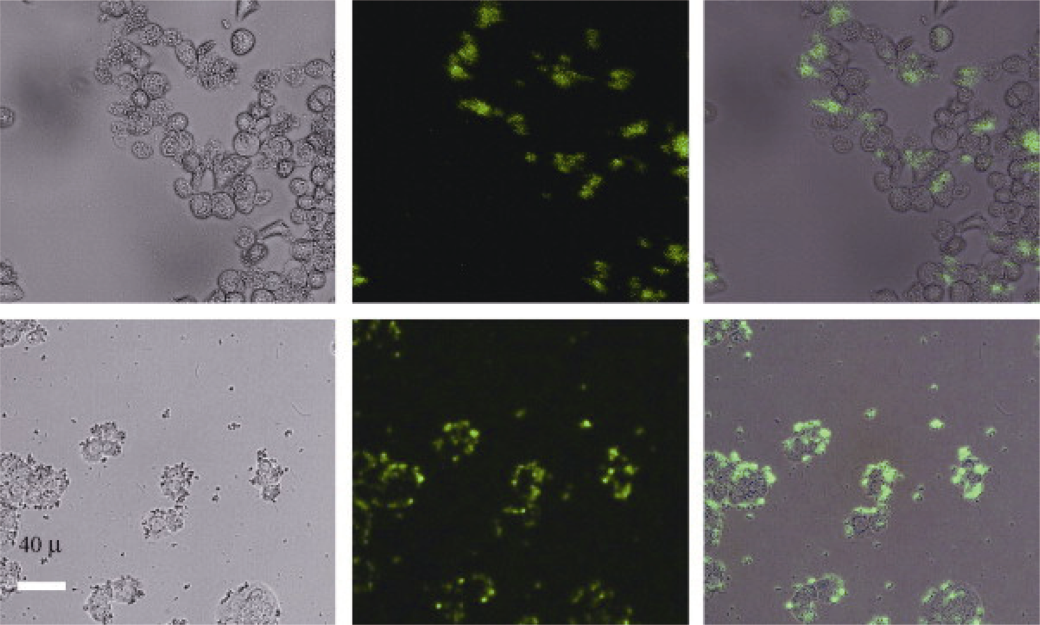
图5
PEI/NaYF4纳米颗粒用于人卵巢癌细胞和人结肠腺癌细胞的成像照片[44]
正文中引用本图/表的段落
UCNPs的UCL成像作为荧光成像领域的一个重要分支, 其应用范围现已从细胞成像拓展至活体动物成像[32,42 -43]。2008年Chatterjee等[44]首次以量子点作为对照, 证实了UCNPs能够在小动物体内实现更深层的组织成像。研究发现, 被聚乙烯亚胺(Polyethyleneimine, PEI)包覆的NaYF4: Yb, Er纳米颗粒的平均直径约为50 nm, 其可在生理缓冲盐水中保持较好的稳定性和较高的耐光漂白性, 同时对骨髓干细胞的毒性较低。在细胞荧光成像和活体皮下注射实验中, UCNPs在NIR光激发下展现出清晰的UCL成像效果。此外, 基于抗原-抗体和配体-受体等特异性相互作用, 修饰后的UCNPs可用于细胞特异性标记, 实现了人卵巢癌细胞和人结肠腺癌细胞的主动靶向UCL成像(图5)。自此, 研究人员便开始致力于探索和优化各种策略, 以进一步提高UCL成像的穿透深度和满足临床的不同需求。随后, Chen等[45]开发了一种UCNPs介导的NIR光遗传刺激技术, 实现了脑部深层区域神经元的特异性标记。Tian等[46]也制备了可发射单色红光的锰掺杂UCNPs, 实现了成像深度达15 mm的体内UCL成像。
Bright field (left), confocal (middle), and superimposed (right) images of live human ovarian carcinoma cells (OVCAR3, top row) and human colon adenocarcinoma cells (HT29, bottom row). Nanoparticles were surface modified with folic acid. ... Near-infrared deep brain stimulation via upconversion nanoparticle-mediated optogenetics 1 2018 ... UCNPs的UCL成像作为荧光成像领域的一个重要分支, 其应用范围现已从细胞成像拓展至活体动物成像[32,42 -43].2008年Chatterjee等[44]首次以量子点作为对照, 证实了UCNPs能够在小动物体内实现更深层的组织成像.研究发现, 被聚乙烯亚胺(Polyethyleneimine, PEI)包覆的NaYF4: Yb, Er纳米颗粒的平均直径约为50 nm, 其可在生理缓冲盐水中保持较好的稳定性和较高的耐光漂白性, 同时对骨髓干细胞的毒性较低.在细胞荧光成像和活体皮下注射实验中, UCNPs在NIR光激发下展现出清晰的UCL成像效果.此外, 基于抗原-抗体和配体-受体等特异性相互作用, 修饰后的UCNPs可用于细胞特异性标记, 实现了人卵巢癌细胞和人结肠腺癌细胞的主动靶向UCL成像(图5).自此, 研究人员便开始致力于探索和优化各种策略, 以进一步提高UCL成像的穿透深度和满足临床的不同需求.随后, Chen等[45]开发了一种UCNPs介导的NIR光遗传刺激技术, 实现了脑部深层区域神经元的特异性标记.Tian等[46]也制备了可发射单色红光的锰掺杂UCNPs, 实现了成像深度达15 mm的体内UCL成像. ... Mn2+ dopant-controlled synthesis of NaYF4: Yb/Er upconversion nanoparticles for in vivo imaging and drug delivery 1 2012 ... UCNPs的UCL成像作为荧光成像领域的一个重要分支, 其应用范围现已从细胞成像拓展至活体动物成像[32,42 -43].2008年Chatterjee等[44]首次以量子点作为对照, 证实了UCNPs能够在小动物体内实现更深层的组织成像.研究发现, 被聚乙烯亚胺(Polyethyleneimine, PEI)包覆的NaYF4: Yb, Er纳米颗粒的平均直径约为50 nm, 其可在生理缓冲盐水中保持较好的稳定性和较高的耐光漂白性, 同时对骨髓干细胞的毒性较低.在细胞荧光成像和活体皮下注射实验中, UCNPs在NIR光激发下展现出清晰的UCL成像效果.此外, 基于抗原-抗体和配体-受体等特异性相互作用, 修饰后的UCNPs可用于细胞特异性标记, 实现了人卵巢癌细胞和人结肠腺癌细胞的主动靶向UCL成像(图5).自此, 研究人员便开始致力于探索和优化各种策略, 以进一步提高UCL成像的穿透深度和满足临床的不同需求.随后, Chen等[45]开发了一种UCNPs介导的NIR光遗传刺激技术, 实现了脑部深层区域神经元的特异性标记.Tian等[46]也制备了可发射单色红光的锰掺杂UCNPs, 实现了成像深度达15 mm的体内UCL成像. ... Using 915 nm laser excited Tm3+/Er3+/Ho3+-doped NaYbF4 upconversion nanoparticles for in vitro and deeper in vivo bioimaging without overheating irradiation 1 2011 ... 为了获得高量子产率, 通常将Yb3+作为敏化剂掺杂UCNPs, 并以980 nm光激发.这种策略的挑战是: 首先, 生物组织中的水分子、黑色素等有机物对波长980 nm的光有强吸收作用, 致使激发光强度在穿透生物组织时显著衰减, 降低了激发效率; 其次, 连续使用波长980 nm的光照射生物组织时会引发过热效应, 对正常细胞和组织造成损伤.为解决上述问题, Zhan等[47]设计制备了一种可用915 nm光激发的UCNPs, 不过其较弱的荧光发射无法进一步满足生物医学应用的要求.此后, 人们制备了一种新的UCNPs, 可用808 nm光对其激发, 避开了激发光源带来的热损伤效应, 在一定程度上提高了UCL效率.Wang等[48]设计制备了Nd3+敏化的NaGdF4: Er3+/Yb3+@NaGdF4: Yb3+/Nd3+纳米颗粒, 在808 nm光激发下, 实现了高效UCL成像.其核壳中的Yb3+作为能量转移的桥接离子, 构建了有效的能量转移路径(Nd3+→Yb3+→Er3+).除此之外, Liu等[49]构建了一种Nd3+敏化的具有核壳结构的NaYF4: Yb, Er@NaYF4: Yb@NaNdF4: Yb@NaYF4: Yb@PAA纳米颗粒, 并将其应用于UCL成像探针和抗癌药物释放.在此基础上, Guo等[50]将UCNPs荧光探针免疫标记到HeLa细胞的肌动蛋白纤维, 实现了亚细胞结构的多色超分辨生物成像(图6).荧光素偶联NaYF4: Nd免疫标记的HeLa细胞肌动蛋白在740 nm波长高斯光束激发下, 显示出“甜甜圈”样的超分辨图像. ... Nd3+-sensitized upconversion nanophosphors: efficient in vivo bioimaging probes with minimized heating effect 1 2013 ... 为了获得高量子产率, 通常将Yb3+作为敏化剂掺杂UCNPs, 并以980 nm光激发.这种策略的挑战是: 首先, 生物组织中的水分子、黑色素等有机物对波长980 nm的光有强吸收作用, 致使激发光强度在穿透生物组织时显著衰减, 降低了激发效率; 其次, 连续使用波长980 nm的光照射生物组织时会引发过热效应, 对正常细胞和组织造成损伤.为解决上述问题, Zhan等[47]设计制备了一种可用915 nm光激发的UCNPs, 不过其较弱的荧光发射无法进一步满足生物医学应用的要求.此后, 人们制备了一种新的UCNPs, 可用808 nm光对其激发, 避开了激发光源带来的热损伤效应, 在一定程度上提高了UCL效率.Wang等[48]设计制备了Nd3+敏化的NaGdF4: Er3+/Yb3+@NaGdF4: Yb3+/Nd3+纳米颗粒, 在808 nm光激发下, 实现了高效UCL成像.其核壳中的Yb3+作为能量转移的桥接离子, 构建了有效的能量转移路径(Nd3+→Yb3+→Er3+).除此之外, Liu等[49]构建了一种Nd3+敏化的具有核壳结构的NaYF4: Yb, Er@NaYF4: Yb@NaNdF4: Yb@NaYF4: Yb@PAA纳米颗粒, 并将其应用于UCL成像探针和抗癌药物释放.在此基础上, Guo等[50]将UCNPs荧光探针免疫标记到HeLa细胞的肌动蛋白纤维, 实现了亚细胞结构的多色超分辨生物成像(图6).荧光素偶联NaYF4: Nd免疫标记的HeLa细胞肌动蛋白在740 nm波长高斯光束激发下, 显示出“甜甜圈”样的超分辨图像. ... Poly(acrylic acid) modification of Nd3+-sensitized upconversion nanophosphors for highly efficient UCL imaging and pH-responsive drug delivery 1 2015 ... 为了获得高量子产率, 通常将Yb3+作为敏化剂掺杂UCNPs, 并以980 nm光激发.这种策略的挑战是: 首先, 生物组织中的水分子、黑色素等有机物对波长980 nm的光有强吸收作用, 致使激发光强度在穿透生物组织时显著衰减, 降低了激发效率; 其次, 连续使用波长980 nm的光照射生物组织时会引发过热效应, 对正常细胞和组织造成损伤.为解决上述问题, Zhan等[47]设计制备了一种可用915 nm光激发的UCNPs, 不过其较弱的荧光发射无法进一步满足生物医学应用的要求.此后, 人们制备了一种新的UCNPs, 可用808 nm光对其激发, 避开了激发光源带来的热损伤效应, 在一定程度上提高了UCL效率.Wang等[48]设计制备了Nd3+敏化的NaGdF4: Er3+/Yb3+@NaGdF4: Yb3+/Nd3+纳米颗粒, 在808 nm光激发下, 实现了高效UCL成像.其核壳中的Yb3+作为能量转移的桥接离子, 构建了有效的能量转移路径(Nd3+→Yb3+→Er3+).除此之外, Liu等[49]构建了一种Nd3+敏化的具有核壳结构的NaYF4: Yb, Er@NaYF4: Yb@NaNdF4: Yb@NaYF4: Yb@PAA纳米颗粒, 并将其应用于UCL成像探针和抗癌药物释放.在此基础上, Guo等[50]将UCNPs荧光探针免疫标记到HeLa细胞的肌动蛋白纤维, 实现了亚细胞结构的多色超分辨生物成像(图6).荧光素偶联NaYF4: Nd免疫标记的HeLa细胞肌动蛋白在740 nm波长高斯光束激发下, 显示出“甜甜圈”样的超分辨图像. ... Achieving low-power single-wavelength-pair nanoscopy with NIR-II continuous-wave laser for multi-chromatic probes 3 2022 ... 为了获得高量子产率, 通常将Yb3+作为敏化剂掺杂UCNPs, 并以980 nm光激发.这种策略的挑战是: 首先, 生物组织中的水分子、黑色素等有机物对波长980 nm的光有强吸收作用, 致使激发光强度在穿透生物组织时显著衰减, 降低了激发效率; 其次, 连续使用波长980 nm的光照射生物组织时会引发过热效应, 对正常细胞和组织造成损伤.为解决上述问题, Zhan等[47]设计制备了一种可用915 nm光激发的UCNPs, 不过其较弱的荧光发射无法进一步满足生物医学应用的要求.此后, 人们制备了一种新的UCNPs, 可用808 nm光对其激发, 避开了激发光源带来的热损伤效应, 在一定程度上提高了UCL效率.Wang等[48]设计制备了Nd3+敏化的NaGdF4: Er3+/Yb3+@NaGdF4: Yb3+/Nd3+纳米颗粒, 在808 nm光激发下, 实现了高效UCL成像.其核壳中的Yb3+作为能量转移的桥接离子, 构建了有效的能量转移路径(Nd3+→Yb3+→Er3+).除此之外, Liu等[49]构建了一种Nd3+敏化的具有核壳结构的NaYF4: Yb, Er@NaYF4: Yb@NaNdF4: Yb@NaYF4: Yb@PAA纳米颗粒, 并将其应用于UCL成像探针和抗癌药物释放.在此基础上, Guo等[50]将UCNPs荧光探针免疫标记到HeLa细胞的肌动蛋白纤维, 实现了亚细胞结构的多色超分辨生物成像(图6).荧光素偶联NaYF4: Nd免疫标记的HeLa细胞肌动蛋白在740 nm波长高斯光束激发下, 显示出“甜甜圈”样的超分辨图像. ...
本文的其它图/表
|