Mo掺杂α-MnO2电催化析氧反应的理论研究
王鹏, 靳遵龙, 陈宁光, 刘勇豪
无机材料学报
2022, 37 ( 5):
541-546.
DOI:10.15541/jim20210280
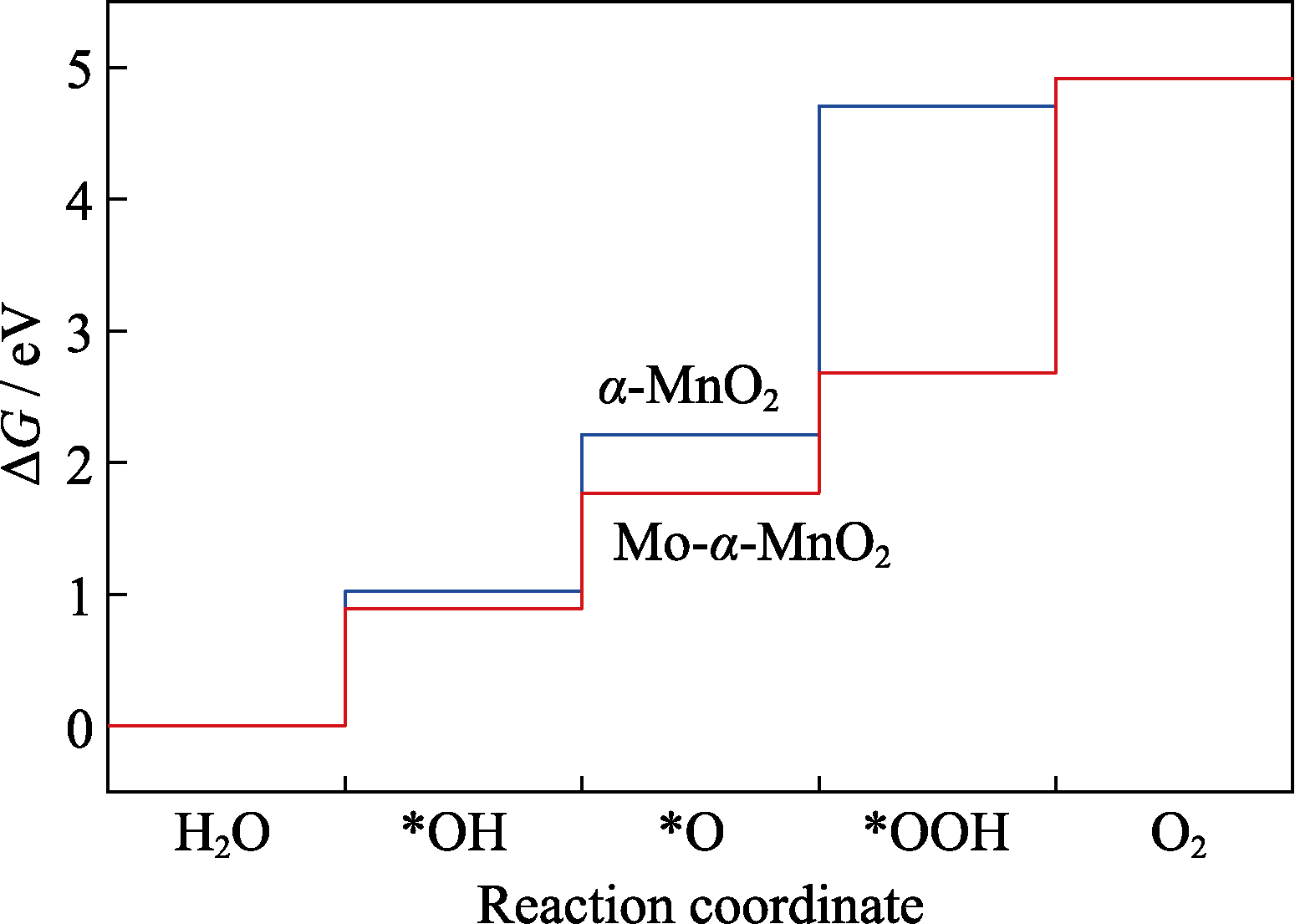
析氧反应(Oxygen Evolution Reaction, OER)在解决能源短缺和环境问题中扮演了重要角色, 但需要巨大的过电位克服缓慢的动力学势垒, 因此开发高效电催化剂成为不可或缺的一步。本工作应用密度泛函理论研究了α-MnO2(001)和Mo掺杂α-MnO2(001)的电催化析氧反应性能, 根据反应路径计算了吉布斯自由能、态密度和差分电荷密度。研究结果表明Mo掺杂可以有效调节α-MnO2(001)面的电子结构, 改善中间物和催化剂之间的脱吸附能力, 为OER提供更多的电子。吉布斯自由能结果表明Mo掺杂α-MnO2(001)体系中*OOH生成O2是发生OER的决速步骤, Mo掺杂降低了过电位, 产生的过电位为1.01 V, 表现出良好的析氧催化性能。
View image in article
图2
α-MnO2和Mo掺杂α-MnO2的OER自由能图
正文中引用本图/表的段落
在OER四步反应中, 每一步都会发生电子转移。通过计算每一步的反应自由能, 可以得到OER的决速步骤和过电位。未掺杂α-MnO2相应的反应自由能为∆G*OH=1.02 eV, ΔG*O=2.21 eV, ΔG*OOH= 4.71 eV, 根据公式(6~9)可以得到ΔG1=1.02 eV, ΔG2=1.19 eV, ΔG3=2.50 eV, ΔG4=0.21 eV, 而Mo掺杂α-MnO2相应的反应自由能为ΔG*OH=0.89 eV, ΔG*O=1.77 eV, ΔG*OOH=2.68 eV, 可以得到ΔG1= 0.89 eV, ΔG2=0.88 eV, ΔG3=0.91 eV, ΔG4=2.24 V, 为更直观地展示OER活性, 绘制了α-MnO2和Mo-α- MnO2的OER吉布斯自由能图(图2)。由图2可见未掺杂α-MnO2(001)面中间物*O氧化生成*OOH是整个析氧反应发生的决速步骤[24], 根据公式(10)可以计算得到理论上的过电位为1.27 V。而在Mo掺杂α-MnO2(001)面中间物*OOH生成O2是发生析氧反应的决速步骤[25], 理论上的过电位为1.01 V, 与未掺杂表面相比下降了0.26 V, 提高了OER性能, 与实验合成α(K)-MnO2产生的0.54 V过电位相比仍有差距[26]。中间物*OH、*O和*OOH在催化剂上的吸附强度影响了OER性能, 掺杂Mo可以调节中间物的活化能, 有效平衡各步反应间的反应能垒, 改善α-MnO2(001)面发生析氧反应的催化活性, 促进了水裂解反应。
本文的其它图/表
|