1 实验方法
1.1 原料及试剂
氯化钠、碳酸氢钠、氯化钾、磷酸氢二钾、氯化镁、N,N-二甲基乙酰胺(Dimethylacetamide, DMAC), 盐酸、氯化钙、硫酸钠、Tris均为分析纯, 由成都科龙化工试剂厂出品。直径20 μm的球状HA粉体由四川大学国家生物医学材料工程技术研究中心制备。血清白蛋白(BSA)由美国BI公司生产; 无钙镁离子的PBS缓冲液由美国GIBCO公式生产; 钙离子试剂盒、BCA法蛋白定量测试盒由南京建成生物制剂有限公司生产。
1.2 微振动参数
1.3 HA陶瓷材料制备
1.3.1 制备具有不同表面微孔隙率的HA片
将5 g无水氯化锂加入100 mL DMAC中, 加入0.7 g甲壳素, 溶解后形成溶胶。按照HA/Chitin质量比10 : 1、20 : 1和35 : 1分别向溶胶体系中加入HA粉末, 搅拌均匀, 密封静置24 h后倒入24孔板内, 每孔加入4 mL浆料, 静置2 h后加入去离子水得到凝胶化的HA片。用去离子水将三组样品充分洗涤后干燥, 常压烧结至1200 ℃(升温速率为2.5 ℃/min)即得到具有不同微孔隙率的HA片, 分别用HA10、HA20、HA35表示。
1.3.2 模板法制备HA多孔支架
1.4 材料表征
利用密度法测定HA片的微孔隙率; 采用液体置换法测定HA多孔支架的总孔隙率。Brunauer-Emmett- Teller (BET)法计算HA片的比表面积; 扫描电子显微镜(FEI Quanta 200)观察分析材料的表面微形貌; X-射线衍射仪(XRD, XD1000)分析材料相组成。密度法测定孔隙率的公式如下:
ρ0为H A理论密度(3.16 g/cm3); m为单颗HA球形颗粒的质量; V0为致密的HA球形颗粒的体积; V1为实测HA球形颗粒的体积。
液体置换法测定总孔隙率的公式如下:
1.5 MVS对HA陶瓷生物活性的影响
取三组HA(HA10、HA20、HA35)片按5 g/100 mL的比例浸泡在不含钙镁的PBS中, 置于37 ℃, 分为40 Hz组、60 Hz组和静态组, 在浸泡3、7、14 d后, 取样品上清液, 在碱性环境中与甲基百里香酚蓝(MTB)结合, 生成蓝色络合物, 通过比色与同样处理的钙标准进行比较, 计算样本中钙离子的含量, 再计算样品单位质量钙离子释放浓度。
取三组HA(HA10、HA20、HA35)片按5 g/100 mL的比例加入2 mg/mL的BSA溶液, 置于37 ℃, 分为40 Hz组、60 Hz组和静态组, 浸泡1、3 d后, 用BCA试剂盒测定上清液中蛋白质含量, 再根据质量守恒原则计算单位样品蛋白吸附量。
取三组HA(HA10、HA20、HA35)片按5 g/100 mL的比例浸泡在仿生矿化液SBF中, 置于37 ℃, 分为40 Hz组、60 Hz组和静态组, 进行仿生矿化实验, 每24 h更换一次, 共矿化3、7 d。纯净水和乙醇轻柔冲洗样品, 80 ℃干燥24 h, 用扫描电镜观察矿化沉积物形貌, EDS能谱分析钙磷比。
1.6 力学稳定性测试
将多孔HA支架分为40 Hz组、60 Hz组和静态组, 按照5 g/100 mL的比例浸入无钙镁PBS缓冲液中, 置于37 ℃, 在0、7、14 d取样, 用纯净水和无水乙醇轻柔冲洗样品, 150 ℃干燥24 h, 用电子万能力学测试机(INSTRON, 美国)测试(载荷速率为 0.5 mm/min, 载荷测量精度为1 N, 变形测量精度为0.005 mm)函数记录仪记录载荷-变形曲线。
2 结果与讨论
2.1 成分分析及表面微形貌观察
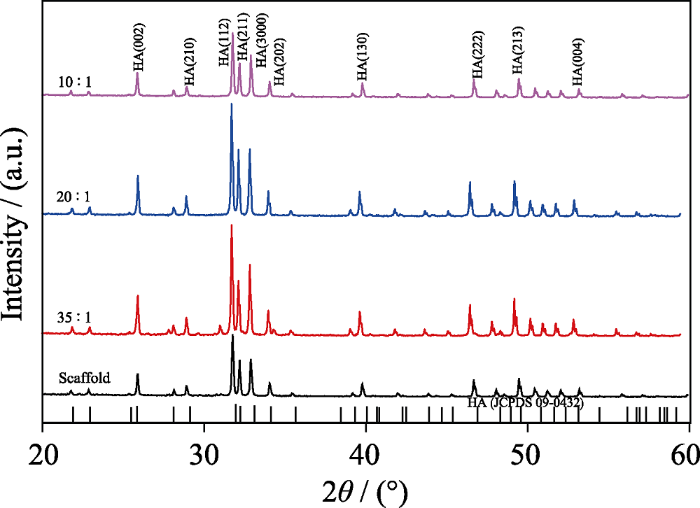
烧结后三组HA片和HA多孔支架的XRD结果(图1)显示, 各组样品经过1200 ℃高温烧结后, 在约26°、32°、40°、47°、50°的位置均出现了明显的HA特征峰, 与标准图谱完全吻合(JCPDS09-0432), 且未见其他杂相, 说明本研究所制备的HA材料在制备和烧结过程中没有引入其他物质。
图1
图1
HA10、HA20、HA35和HA多孔支架烧结后XRD图谱
Fig. 1
XRD patterns of HA10, HA20, HA35 and porous HA scaffolds
扫描电镜观察结果显示(图2), HA10表面存在大量微孔, 且尺寸分布在10 μm以下, 部分微孔尺寸小于1 μm, HA20微孔数量少于HA10, HA35表面光滑、致密, 仅存在少数微孔。多孔HA支架的总孔隙率为(87.7±2.2)%, 其表面形貌与HA20相似, 这是因为两者的浆料配制比例相同。
图2
图2
HA材料的SEM照片
Fig. 2
SEM images of HA materials
(a) HA10; (b) HA20; (c) HA35; (d) HA porous scaffold; (d1) Partial magnification of porous scaffolds
2.2 MVS应力环境下HA材料的钙离子释放
微孔隙率检测及BET测试结果显示, 随着HA粉体比例的提高, HA片微孔隙率呈显著下降趋势, HA10微孔隙率为(29±1.2)%, 比表面积为121.97 m2/g; HA20微孔隙率为(26.4±0.3)%, 比表面积为87.41 m2/g; HA35微孔隙率为(10.6±0.8)%, 比表面积为16.53 m2/g。
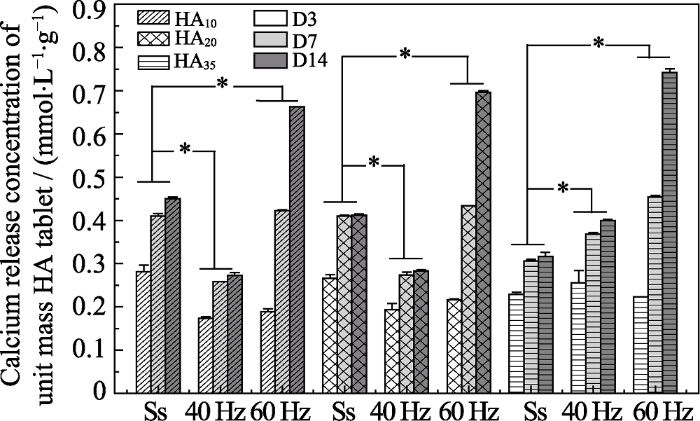
钙离子释放结果显示(图3), 三组HA片在静态和微振动环境下其单位质量钙离子释放浓度均随时间延长而增加, 这说明钙离子释放具有时间累积效应。静态组中随着HA材料微孔隙率的降低, Ca2+释放浓度随之显著下降, 这是因为比表面积的降低使得钙磷溶解度减小; 而振动组(40 Hz组和60 Hz组)的结果却呈相反趋势, 随着微孔隙率的降低, Ca2+释放浓度呈显著上升态势。此外, 对于具有较高微孔隙率(10%)的HA材料, 在40 Hz的MVS应力环境下Ca2+释放浓度显著低于静态环境, 而在60 Hz时Ca2+释放浓度在初期降低, 随后显著增高; 对于微孔隙率较低(35%)的HA35组, 随着频率的增加, Ca2+释放浓度相较于静态环境则始终呈现显著上升的趋势。这说明40 Hz应力环境能促进具有较高微孔隙率HA材料的钙离子再沉积, 同时有利于具有低微孔隙率HA材料的钙磷溶解; 而60 Hz应力环境则能促进全部HA材料的钙磷溶解。这可能是因为对于微孔隙率较高的HA材料来说, 其本身较大的比表面积有利于钙离子的释放, 局部钙离子浓度已经接近饱和浓度, 中低频(40 Hz)的MVS所引起的流体双向流动使材料局部钙离子浓度很快达到过饱和, 从而引起了钙磷的再沉积, 因此溶液中钙离子浓度较静态组显著降低; 而高频(60 Hz)MVS尽管在早期也引起了钙磷的再沉积, 但高频所致的流场流体行为最终更利于钙离子释放。对于低微孔隙率HA材料, 其比表面积较小, 钙离子释放少, 因此MVS对其的影响以促进钙离子释放为主, 频率越高, 钙离子释放越多。此外, 材料在静态环境和中低频MVS应力环境中的钙离子释放在沉积到第14 d时已经趋于平衡状态, 而在高频MVS应力环境中则明显仍以钙离子释放为主。Zhi等[10]的研究证实微孔隙率通过对磷酸钙生物陶瓷比表面积的影响来调控蛋白吸附和钙离子的释放/再沉积过程, 从而影响磷酸钙陶瓷的生物活性。本研究的结果则进一步表明应力环境和材料结构因素对于材料钙离子释放/再沉积过程具有共同调控作用。
图3
图3
微振动对不同微孔隙率HA陶瓷片钙离子释放的影响
Fig. 3
Calcium release concentration of HA slices with different mass fraction (HA10, HA20, HA35) under 40 Hz and 60 Hz frequency and static state incubation environment at d3, d7 and d14
(* represents statistical difference, P<0.05)
2.3 MVS应力环境下HA材料的蛋白吸附研究
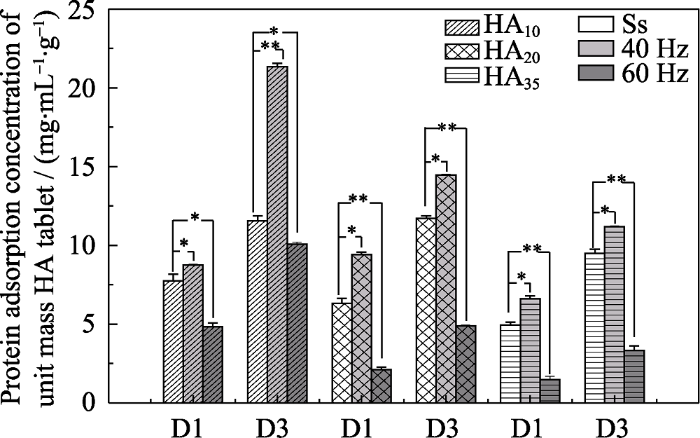
蛋白吸附结果(图4)显示, 三组HA片在静态环境和MVS应力环境下单位质量吸附量均随时间增加, 并随着微孔隙率的降低而呈现下降趋势, 这说明HA10在表面具有最多吸附位点, 这应该与其具有最大比表面积相关。40 Hz 的MVS应力环境下三组HA片的蛋白吸附量均显著高于静态环境, 而60 Hz的MVS应力环境下三组HA片的蛋白吸附量又显著低于静态组。这可能与MVS环境下流体在材料表面流动带来的剪切应力有关[10], 不同频率的MVS明显影响了流体的剪切应力, 从而对材料的蛋白吸附行为造成了显著的影响。表面吸附蛋白质是生物材料植入体内后在体液环境下的初始行为, 这一行为对于随后发生的细胞行为及最终植入物的使用效果起着重要的作用[24]。一般认为, 材料对蛋白的吸附量与其比表面积呈正性相关[31,32]。本实验结果与该结论一致, 并进一步揭示了应力环境在磷酸钙陶瓷蛋白吸附行为中所起到的重要调控作用。
图4
图4
微振动对不同微孔隙率HA片蛋白吸附的影响
Fig. 4
Protein adsorption concentration of HA discs with different mass fraction (HA10, HA20, HA35) under 40 Hz and 60 Hz frequency and static state incubation environment at d1 and d3
(* represents statistical difference, P<0.05)
2.4 MVS应力环境下HA材料的仿生矿化研究
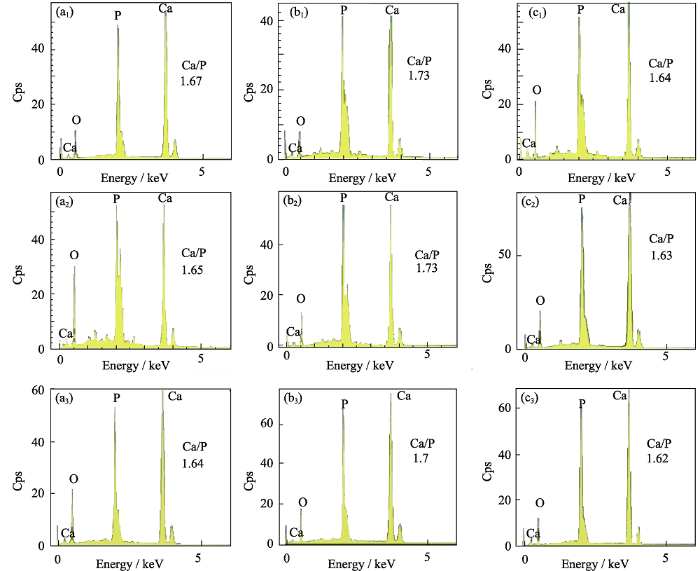
三组HA片在静态和MVS应力环境中置于SBF溶液中分别浸泡3和7 d后, 表面矿化情况如图5所示。在静态环境中, 矿化3 d后, HA10组和HA20组均在表面观察到大量片状矿化物沉积, HA35组则为散开的片状和颗粒状矿化物混合沉积, 且矿化沉积物分布为HA10组>HA20组>HA35组(图5(a1)、(a3)、(a5))。7 d后在HA10组和HA20组表面的片状矿化层覆盖更为密集, 而在HA35组表面沉积的矿化物较3 d时明显增多, 主要以颗粒状和絮状为主(图5(a2)、(a4)、(a6))。在40 Hz的MVS应力环境下, HA10组和HA20组在矿化3 d时即观察到材料表面有均匀致密的颗粒状矿化层的覆盖, 并在矿化层上观察到絮状矿化沉积物, HA35组表面颗粒状矿化沉积物零散分布(图5 (b1)、(b3)、(b5)); 7 d时HA10组和HA20组矿化层明显增厚, 矿化层上的絮状矿化物增多、增大, HA35组表面颗粒状矿化物增多, 但与静态组相比矿化沉积量较少(图5(b2)、(b4)、(b6))。在60 Hz的MVS应力环境下, 三组HA材料在矿化3 d时表面矿化沉积情况均与40 Hz时相似(图5(c1)、(c3)、(c5)), 但在矿化7 d时HA10组和HA20组表面矿化沉积物并未见明显增多; 而HA35组表面矿化沉积物则更为疏松(图5(c2)、(c4)、(c6))。EDS能谱分析结果(图6)显示, 矿化7 d的三组样品在静态组、40 Hz组和60 Hz组的钙磷比均在1.62~1.73的范围内。研究发现在仿生矿化过程中, Ca/P摩尔比在1.5~1.67范围内, 产物为HA+β-TCP(β-Ca3(PO4)2), 当Ca/P摩尔比在1.68~1.7范围内时, 产物为HA, 当Ca/P摩尔比大于或等于1.7时, 产物为HA + CaO[33]。该结果证实了沉积产物是类骨磷灰石。
图5
图5
HA在SBF溶液中3, 7 d后的SEM照片
Fig. 5
SEM results of HA ceramic discs with different mass fraction soaked in SBF solution for 3 and 7 d
(a) Static state; (b) 40 Hz; (c) 60 Hz; 1: HA10-at d 3; 2: HA10- at d 7; 3: HA20- at d 3; 4: HA20- at d 7; 5: HA35- at d 3; 6: HA35- at d 7
图6
图6
HA材料浸泡在SBF溶液中7 d后的EDS能谱分析
Fig. 6
EDS spectra of HA materials after 7 d in SBF solution
(a) Static state; (b) 40 Hz; (c) 60 Hz; 1: HA10-at d 7; 2: HA20-at d 7; 3: HA35-at d 7
磷酸钙陶瓷的仿生矿化过程包括两个阶段: 晶核形成和晶核长大[11]。材料表面的局域钙磷浓度被认为是成核的关键[12]。具有较大比表面积的磷酸钙陶瓷能提供更多的磷灰石晶体的成核位点, 更容易促进钙磷矿化层的成核生长, 并且更高的微孔隙率使得更多的来自于材料的Ca2+、PO43-、HPO42-扩散到周围, 从而使得钙磷再沉积更容易发生。磷酸钙源的存在是发生异位骨形成的前提条件之一[34,35]。而本研究的结果表明, 中低频的MVS应力环境能够更好地促进具有较高微孔隙率的HA钙磷离子的矿化沉积, 而对具有较低微孔隙率的HA矿化沉积则显示出抑制作用; 高频的MVS应力环境从最终结果来看并不利于HA的矿化沉积。这可能是因为中低频的微振动环境使得模拟体液处于往复流动状态, 这种流动状态加速了表面钙磷离子溶出。由于粗糙表面具有较多的微孔, 这些区域会阻碍液体的流动和离子的扩散, 因而较快地达到成核阈值, 一旦晶核形成, 流动状态更有利于离子的交换, 晶核很快长大并均匀分布。而光滑致密表面由于缺少这些“阻碍区域”, 因此离子容易扩散, 不利于材料表面的离子浓度达到成核阈值。对于高频的微振动环境, 模拟体液流速过快以致材料表面的钙磷离子扩散较快, 不利于离子浓度达到成核阈值, 因此抑制了HA材料表面类骨磷灰石的形成[12,14,36]。
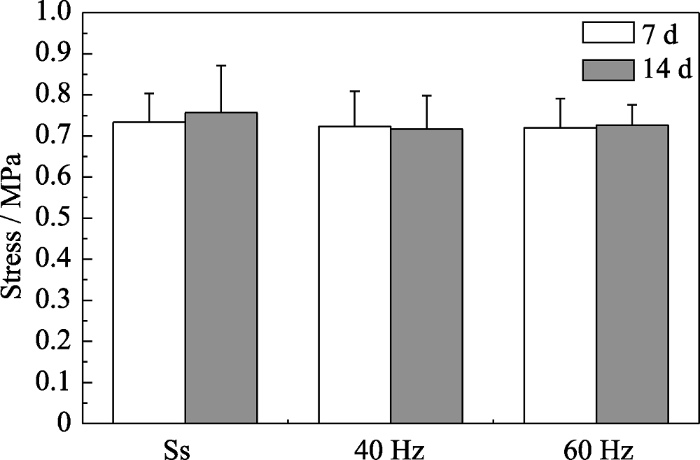
2.5 MVS应力环境下HA多孔支架的抗压性能
抗压试验结果显示(图7), MVS应力环境对HA多孔支架力学稳定性没有明显影响。在40和60 Hz的MVS环境中浸泡7和14 d后, HA多孔支架的抗压强度仍与初始强度相仿。这意味着微振动不会显著影响HA多孔支架的抗压强度。这可能是因为HA具有极低的体外降解速度, 即使在MVS应力环境促进其钙离子释放的情况下, 材料的降解也是极其有限的。骨生物支架的降解行为对细胞长入、宿主反应和组织再生有重要作用[10]。理想的支架降解速度应与新生骨组织再生的速度相匹配。而骨形成是一个缓慢的过程, 尤其是在支架植入初期, 因此支架的力学稳定性就成为再生修复成功的前期要素之一。虽然理论上植入物能发生更快的改建过程是一个优点, 但从临床角度来看对改善修复失败或是并发症的发生并无明显效果[10]。前述HA陶瓷生物活性体外评价实验的结果已经显示在MVS应力环境下得到的评价结果可能更真实可靠, 因此实验证明MVS应力环境不至于造成HA多孔支架的力学性能破坏, 具有重要的临床应用指导意义。
图7
图7
微振动对HA多孔支架抗压强度的影响
Fig. 7
Compressive strength of HA porous scaffold under static state, 40 and 60 Hz vibration frequency incubated for 7 and 14 d
3 结论
本研究首次尝试在体外构建MVS应力环境来模拟体内生理应力环境, 从而得到更真实准确的HA生物活性和力学稳定性评价结果, 这将有助于骨诱导性磷酸钙陶瓷的设计和优选, 并为深入理解磷酸钙陶瓷骨诱导机制提供理论依据和实验基础。
研究证实应力环境是影响HA陶瓷生物活性和骨诱导性的重要因素, 并且这种力学因素与材料本身的理化因素共同作用于HA陶瓷的生物活性。在没有影响HA支架抗压性能的前提下, 具有较高孔隙率HA材料的生物活性在中低频MVS应力环境中得到了明显增强; 但对于较低孔隙率的HA材料, 其在MVS应力环境中生物活性有所降低。
参考文献
Hydroxyapatite formed from coral skeletal carbonate by hydrothermal exchange
Synthesis and characterization of nanoporous hydroxyapatite using cationic surfactants as templates
Calcium phosphate-based osteoinductive materials
Effect of porous structure and pore size on mechanical strength of 3D-printed comby scaffolds
Hemocompatible and bioactive heparin-loaded PCL—TCP fibrous membranes for bone tissue engineering
Anterior cervical fusion with interbody cage containing beta-tricalcium phosphate: clinical and radiological results
Preparation and characterization of multi-shell hollow biphase bioceramic microsphere composite
Mechanical stability of highly porous hydroxyapatite scaffolds during different stages of in vitro studies
3D microenvironment as essential element for osteoinduction by biomaterials
How useful is SBF in predicting in vivo bone bioactivity?
Bone-like apatite formation on calcium phosphate dense ceramics in dynamic SBF
Effect of fluid flow on the in vitro degradation kinetics of biodegradable scaffolds for tissue engineering
A study on the in vitro degradation properties of poly(L-lactic acid)/β-tricalcuim phosphate (PLLA/β-TCP) scaffold under dynamic loading
Osteogenic differentiation of bone marrow-derived mesenchymal stromal cells on bone-derived scaffolds: effect of microvibration and role of ERK1/2 activation
Effects of different frequency of vibration strain on proliferation and differentiation potency in osteoblast in vitro
Boning up on Wolff’s law: mechanical regulation of the cells that make and maintain bone
Shock wave treatment enhances cell proliferation and improves wound healing by ATP release-coupled extracellular signal-regulation kinase(ERK) activation
A review on mechanobiology mechanism of bone formation and remodeling
Preparation and characterization of hydroxyapatite based porous composite scaffolds
Surface microstructure on hydroxyapatite spherules and its regulation on stem cells
Fabrication of translucent hydroxyapatite ceramics with different forms by Sol-Gel method
BAPTA-AM, an intracellular calcium chelator, inhibits RANKL-induced bone marrow macrophages differentiation through MEK/ERK, p38 MAKP and Akt, but not JNK pathways
Study on the elution of the adsorbed serum proteins on biphasic calcium phosphate ceramics
A review of chemical surface modification of bioceramics: effects on protein adsorption and cellular response
Bone mineral: update on chemical composition and structure
Progress in biomineralization of collagen fibers in vitro
The effect of magnesium on hydroxyapatite formation in vitro from CaHPO4 and Ca4(PO4)2O at 37.4 ℃
3D bioactive composite scaffolds for bone tissue engineering
Preparation and characterization of porous scaffolds with favourable interpore connectivity
The effect of macro/micro combination pore structure of biphasic calcium phosphate scaffold on bioactivity
Micropore-induced capillarity enhances bone distribution in vivo in biphasic calcium phosphate scaffolds
Calcium phosphate materials prepared from precipitates with various calcium: phosphorus molar ratios
.[J]
Osteoinductive biomaterials: current knowledge of properties, experimental models and biological mechanisms
Ectopic osteogenesis with biphasic ceramics of hydroxyapatite and tricalcium phosphate in rabbits
Effect of flowing speed on bone-like apatite information in porous calcium phosphate in dynamic RSBF
Osteogenic response to porous hydroxyapatite ceramics under the skin of dogs