化石能源的持续消耗不仅造成CO2过度排放, 而且还引发了一系列能源危机[1,2,3,4], 发展清洁的可再生能源迫在眉睫。采用电化学法将CO2转化为 各种碳产物是一种清洁、高效和有前景的碳循环途径[5]。然而, 目前电化学CO2还原依旧面临巨大的挑战, 比如产物复杂、选择性差等, 尤其是在CO2还原中不可避免的竞争反应析氢[6]。因此, 更多的科学研究聚焦在如何降低CO2还原反应中的副反应析氢。然而, 氢气是一种清洁燃料, 也是合成气的主要成分。在工业应用中, 不同比例的CO/H2能够通过费托合成转化为不同的下游产品(CO/H2=1/1: 甲酰化反应; CO/H2=1/2: 甲醇合成; CO/H2=1/3: 甲烷化反应; CO/H2=1/4: 二甲醚合成), 展示出广阔的应用前景[7,8,9]。因此, 通过合理设计催化剂, 调控CO2还原反应中CO和H2的法拉第效率(FE), 实现CO/H2的可控调控也具有重要的意义。
电催化CO2还原反应中, 所使用的催化剂主要分为贵金属和非贵金属两大类。常见的贵金属催化剂包括Au、Ag、Pd和Ru等[10,11,12], 非贵金属催化剂主要包含Sn基、Cu基和Zn基等材料[13,14]。其中贵金属价格高昂, 极大地限制了其规模化应用[15]。因此, 非贵金属催化剂的开发研制更具有应用价值。近年来, Cu基材料在电催化CO2还原中展现出独特的优势, 它通过多电子转移反应可以将CO2还原为多种碳产物, 同时也会产生副产物H2[16]。通过合理设计Cu基催化剂, 有效利用副产物H2制备合成气, 可以进一步提高资源的利用率。此外, 据文献[17]报道, 在电催化反应中应用电势对CO2还原产物也具有选择性。例如Daiyan等[18]制备的Co@CoNC-900电催化剂, 在-0.5 V (vs. RHE)的电势下, CO/H2的比例为1/2, 而在-0.8 V (vs. RHE)电势下, CO/H2的比例为3/2; Sastre等[19]以氮化碳为载体制备了纳米银电催化剂, 通过调控应用电势和银负载量合成了CO/H2为1/100到1/2的合成气。
因此, 本研究基于Cu基非贵金属材料, 采用金属离子共沉淀法制备了CuO和不同Zn含量的CuO/ ZnO复合纳米材料, 应用于电催化CO2还原产生合成气。探究引入Zn物种对Cu和O化学环境的影响, 研究不同电势下, CuO中引入Zn物种及其含量对CO/H2的影响。最后, 结合物理和电化学表征以及CO形成路径对合成气CO/H2的调控性进行了分析。
1 实验方法
1.1 实验原料
氢氧化钠(NaOH, 分析纯, AR, 国药集团化学试剂有限公司); 二水氯化铜(CuCl2∙2H2O, 分析纯, AR, 国药集团化学试剂有限公司); 氯化锌(ZnCl2, 分析纯, AR, 国药集团化学试剂有限公司); 乙醇(≥99.7%, 上海凌峰化学试剂有限公司)。
1.2 CuO纳米颗粒的制备
首先, 将0.025 mol CuCl2∙2H2O加入装有50 mL去离子水的广口瓶中, 并不断搅拌直至溶解, 接着逐滴加入50 mL NaOH溶液(0.05 mol)并持续搅拌 9 h。静置30 h后离心收集产物, 并用体积比为1/1的乙醇/去离子水溶液重复洗涤两次。将收集的产物在80 ℃烘箱中干燥过夜, 然后在500 ℃的空气气氛中煅烧2 h得到CuO纳米颗粒。
1.3 CuO/ZnO纳米颗粒的制备
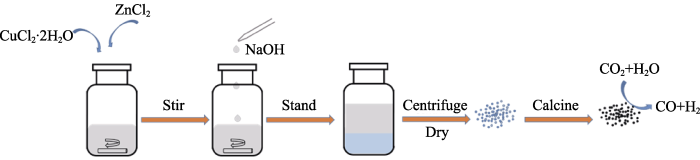
首先, 将0.020、0.0167和0.0125 mol CuCl2∙2H2O分别加入三个装有50 mL去离子水的广口瓶中并搅拌溶解, 接着分别加入0.005、0.0083和0.0125 mol ZnCl2, 搅拌至溶解。然后将50 mL NaOH溶液(0.05 mol)逐滴加入上述铜锌混合溶液中并搅拌9 h。静置30 h后离心收集产物, 并用体积比为1/1的乙醇/去离子水溶液重复洗涤两次。将收集的产物在80 ℃烘箱中干燥过夜, 然后在500 ℃的空气气氛中煅烧2 h得到CuO/ZnO复合纳米颗粒, 如图1所示。得到的产物分别命名为CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3。
图1
图1
CuO及CuO/ZnO催化剂的制备流程及CO2还原示意图
Fig. 1
Schematic representation of the fabrication of CuO and CuO/ZnO catalyst and CO2 reduction process
1.4 电极制备
首先, 将10 mg催化剂溶解于1 mL乙醇和去离子水(体积比1 : 1)的混合溶液中, 超声分散; 然后加入5 mg炭黑(KB)粉末, 继续超声分散30 min; 接着加入20 μL Nafion溶液超声制备催化剂油墨。将40 μL的催化剂油墨涂覆在0.5 cm×1.0 cm的碳纸上制备工作电极, 其中正反面各涂覆20 μL, 并置于室温下干燥过夜。
1.5 物理表征
采用X射线衍射仪(X-ray diffraction, XRD, Rigaku D/Max-2550V)对样品进行物相分析, 测试条件: 电压40 kV, 电流40 mA, CuKα辐射源, 2θ= 5°~80°, 扫描速度4 (°)/min。采用透射电子显微镜(TEM)和高分辨透射电子显微镜(HRTEM, JEM- 2100F)对样品进行形貌观察, 以电镜自带的能谱仪(EDX)进行元素分布测试; 采用Micromeritics Trister 2000测试N2吸附/解吸曲线; 采用X射线光电子能谱(XPS, VG Micro MK II)确定表面元素化。通过傅立叶变换红外光谱仪(ALPHA II)测试材料反应前后的变化, 分析还原机理。
1.6 电化学测试
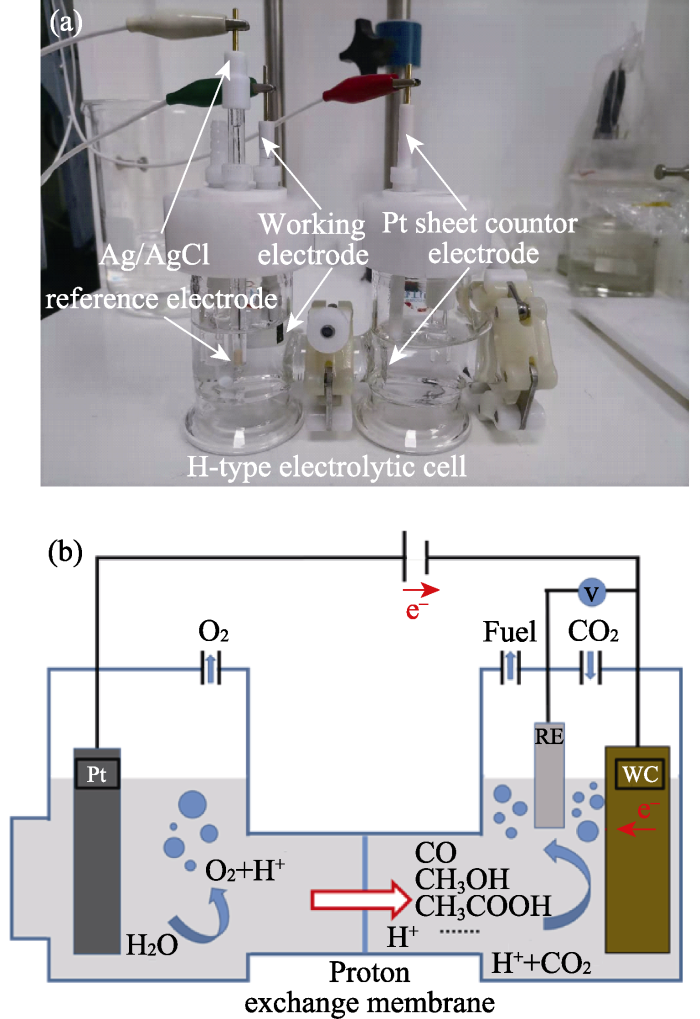
电化学测试均在一个H型密闭的三电极体系电解池中进行(图2), 其中涂覆催化剂的碳纸作为工作电极, 1.5 cm×1.5 cm×2 mm的Pt片和Ag/AgCl电极分别作为对电极和参比电极。线性扫描伏安曲线(LSV)和电化学阻抗(EIS)测试分别在CO2饱和的0.1 mol/L KHCO3溶液中进行, 其中LSV曲线的扫描速率和扫描电势窗口分别为500 mV/s和0.2~-1.2 V (vs. RHE), EIS的测试频率范围为0.1~100 Hz。通过不同扫描速率下的CV曲线估算电化学活性比表面积(ECSA)。
图2
图2
电化学CO2还原电解池的(a)实物图和(b)简化模型图
Fig. 2
(a) Physical picture and (b) simplified model diagram for electrolytic cell of electrochemical CO2 reduction
其中, EAg/AgCl为测试时施加的偏压; pH为电解质溶液的pH; FEm为产物μ的FE, Cm为产物μ的浓度, Vm为产物μ的体积, N为产生每单位摩尔产物需要转移的电子数, F为法拉第常数, Q为电荷量。
2 结果与讨论
2.1 催化剂的物理表征
利用TEM、HRTEM、能谱仪和XRD衍射仪对电催化剂的形貌、元素分布及物相组成进行测定。
图3
图3
催化剂(a, e) CuO、(b, f) CuO/ZnO-1、(c, g) CuO/ZnO-2和(d, h) CuO/ZnO-3在热解(a~d)前(e~h)后的TEM照片;催化剂CuO/ZnO-2的元素面扫分布图((i) TEM, (j) Cu, (k) O和(l) Zn)
Fig. 3
TEM images of catalysts (a, e) CuO, (b, f) CuO/ZnO-1, (c, g) CuO/ZnO-2 and (d, h) CuO/ZnO-3 (a-d) before and (e-h) after pyrolysis with elemental mapping images of CuO/ZnO-2 ((i) TEM, (j) Cu, (k) O and (l) Zn)
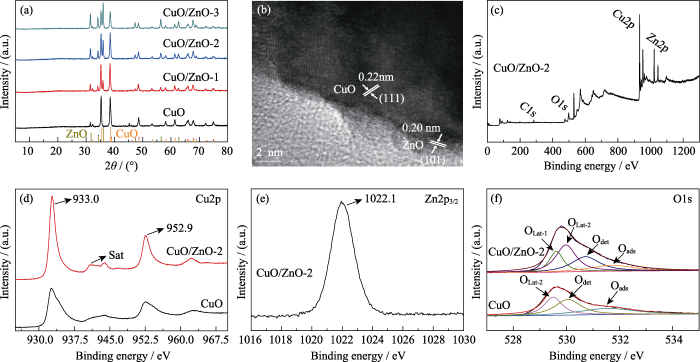
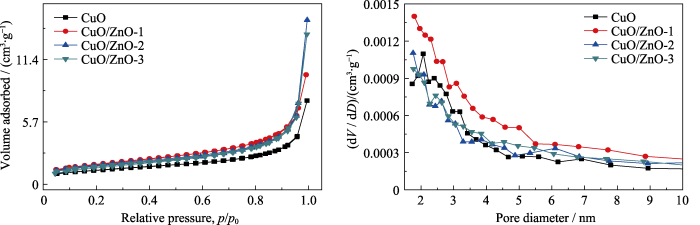
采用XRD和HRTEM分析催化剂的晶型结构, 如图4(a~b)。通过与CuO (PDF#80-1916)和ZnO (PDF#80-0074)的标准卡片对比, 所制备的催化剂CuO在35.4°及38.7°有较强的衍射峰, 说明CuO主要沿(-111)和(111)晶面取向生长。随着Zn物种的引入, 在CuO/ZnO催化剂中逐渐出现ZnO的衍射峰, 并且其衍射峰随着Zn物种含量的增加逐渐增强, 而CuO的衍射峰强度逐渐降低。催化剂CuO/ZnO-2的HRTEM照片如图4(b)所示, 晶格条纹清晰可见, 晶面间距为0.22 nm的晶格条纹对应于CuO的 (111)晶面, 这与XRD的结果相吻合, 而晶面间距为0.20 nm的晶格条纹对应于ZnO的(101)晶面。结果表明, 电催化剂由CuO和ZnO组成。催化剂的N2吸附/解吸曲线和相应的孔径分布曲线如图S1(a~b)所示, CuO、CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3电催化剂的比表面积分别为4.6、6.5、6.2和5.8 m2/g; 孔径分布主要位于2~4 nm, 说明引入Zn物种使电化学活性比表面积略有增大, 但对孔径分布基本无影响。
图4
图4
(a) CuO、CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3电催化剂的XRD图谱; (b) CuO/ZnO-2催化剂的HRTEM照片; (c) CuO/ZnO-2的XPS全谱谱图; (d) CuO/ZnO-2和CuO的Cu2p XPS分图; (e) CuO/ZnO-2的Zn2p3/2 XPS分图; (f) CuO/ZnO-2与CuO的XPS高分辨O1s谱图
Fig. 4
(a) XRD patterns of CuO, CuO/ZnO-1, CuO/ZnO-2 and CuO/ZnO-3 electrocatalysts, (b) HRTEM image of CuO/ZnO-2, (c) total XPS survey of CuO/ZnO-2, (d) XPS Cu2p spectra of CuO/ZnO-2 and CuO, (e) XPS Zn2p3/2 spectrum of CuO/ZnO-2, and (f) XPS high resolution O1s spectra of CuO/ZnO-2 and CuO
Colorful figures are available on website
通过XPS进一步分析催化剂中Zn、O和Cu的化学环境, 如图4(c~f)所示。XPS全谱进一步证明所制备的催化剂CuO/ZnO-2中存在Cu、Zn和O元素(图4(c)), 元素含量如表1所示。图4(d)展示了Cu元素的价态谱, 结合能933.0和952.9 eV附近的峰分别属于Cu2p1/2和Cu2p3/2轨道, 归因于Cu2+。图4(e)展示了Zn元素的价态谱, 1022.1 eV附近的峰属于Zn2p3/2轨道, 归属于Zn2+[22]。图4(f)为高分辨O1s图谱, 其中催化剂CuO拟合为3个峰, 分别在529.5、530.1和531.6 eV, 归属于CuO的晶格氧(OLat-2)、氧缺陷(Odet)和吸附氧(Oads)。催化剂CuO/ZnO-2拟合为4个峰, 出现在529.8、530.0、530.8和531.8 eV, 分别归属于ZnO的晶格氧(OLat-1)、CuO的晶格氧(OLat-2)、氧缺陷(Odet)和吸附氧(Oads)。相比CuO催化剂, 引入Zn物种后, 催化剂CuO/ZnO-2中出现ZnO晶格氧的峰, 而且另外三个峰还发生了一定偏移, 表明CuO和ZnO之间存在电子转移, 它们的电子密度由于CuO和ZnO的相互耦合而发生了改变[23,24,25]。
表1 样品表面元素含量分析
Table 1
| Sample | Atomic percent/% | |||
|---|---|---|---|---|
| Cu | Zn | O | C | |
| CuO | 30.77 | 0 | 43.90 | 25.33 |
| CuO/ZnO-1 | 30.91 | 6.73 | 46.34 | 16.02 |
| CuO/ZnO-2 | 26.78 | 10.39 | 45.98 | 16.85 |
| CuO/ZnO-3 | 19.95 | 12.95 | 42.22 | 25.44 |
2.2 电化学CO2还原性能
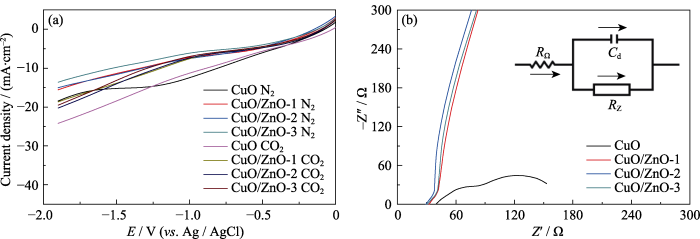
室温下, 催化剂在N2/CO2饱和的0.1 mol/L KHCO3溶液中的线性扫描伏安曲线如图5(a)所示, 结果表明测试电势下无论是在N2氛围还是CO2氛围中, 催化剂CuO和CuO/ZnO的电流密度均随应用偏压的增加而增大, 其中在低于-0.9 V (vs. RHE)的电势下, N2氛围中催化剂的电流密度均小于CO2氛围下对应的电流密度, 说明制备的催化剂具有良好的CO2还原活性。此外, CuO催化剂的电流密度在0.2至-1.2 V (vs. RHE)的电势下始终大于CuO/ZnO催化剂。在CO2氛围中, -1.2 V (vs. RHE)的电势下CuO催化剂的电流密度介于22~24 mA/cm2之间, 而CuO/ZnO催化剂的电流密度小于CuO, 介于16~19 mA/cm2之间, 这可能与CuO和ZnO的导电性差异有关。此外, 随着Zn物种含量的增加, CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3具有相似的电流密度。催化剂的电化学阻抗图谱(EIS)如图5(b)所示, 可以发现CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3催化剂具有相似的阻抗值, 而CuO催化剂的阻抗值较低, 说明CuO催化剂在CO2饱和的KHCO3溶液中具有较大的电荷迁移速率, 这与CO2氛围中LSV曲线电流密度的分析结果相一致。
图5
图5
CuO和CuO/ZnO催化剂(a)在N2/CO2饱和的KHCO3电解液中的线性扫描伏安曲线(LSVs)和(b)电化学阻抗谱图(EIS)
Fig. 5
(a) Linear sweep voltammetry curves (LSVs) in N2/CO2-saturated KHCO3, (b) electrochemical impedance spectra (EIS) of CuO and CuO/ZnO catalyst
Colorful figures are available on website
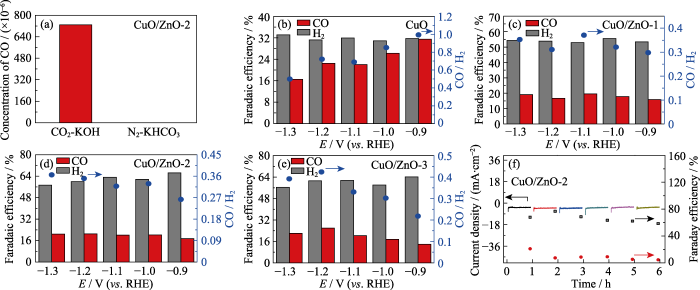
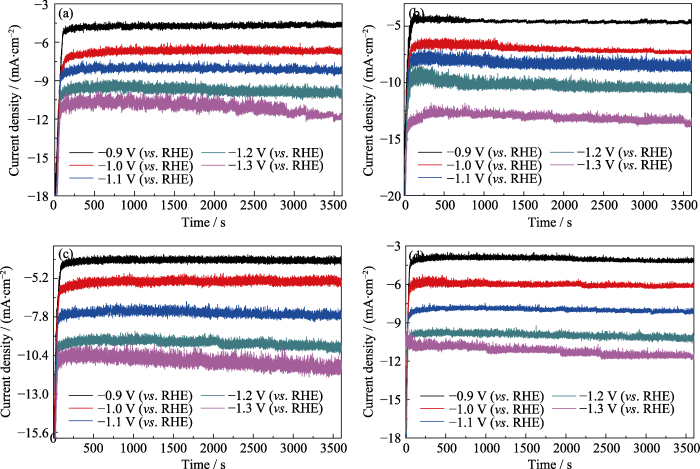
为进一步探究催化剂CuO和CuO/ZnO电催化还原CO2和H2O产生合成气的性能, 通过电流-时间曲线(i-t曲线)测试1 h的还原产物。从图S2(a~d)中可见, 在1 h的测试中, CuO及CuO/ZnO催化剂的电流密度均随应用电势的增加而增大, 这与LSV曲线的结果相一致。此外, 催化剂在不同电势下都具有比较稳定的电流密度, 说明催化剂在1 h的测试中较稳定。为了验证产物CO中碳的来源, 分别在CO2饱和的KOH溶液(CO2-KOH)和N2饱和的KHCO3溶液(N2-KHCO3)测试CO2的还原活性, 结果如图6(a)所示。在CO2-KOH溶液中可以检测到还原产物 CO, 而在N2-KHCO3的溶液中几乎检测不到CO, 表明CO2的还原产物CO主要是来自气相中的CO2。图6(b~e)为不同催化剂对产物CO和H2选择性的测试结果, 表明催化剂CuO(图6(b))在-0.9 V (vs. RHE)的电势下对CO的FE为31.5%, 对H2的FE为31.8%, 可以形成CO/H2为1/1的合成气。随着电势的增加, CO的法拉第效率逐渐降低, H2的法拉第效率无明显变化。当电势增加至-1.3 V (vs. RHE)时, CO的FE降为16.5%, 此时H2的FE为33.1%, 可以形成CO/H2为1/2的合成气。引入Zn物种使还原产物的FE发生明显变化。不同电势下, 催化剂CuO/ZnO对CO的选择性均有所降低, CO的FE在20%左右, 而H2的选择性明显增加。其中催化剂CuO/ZnO-1(图6(c))在不同电势下均可形成CO/H2近似为1/3的合成气, 而催化剂CuO/ZnO-2 (图6(d))在-1.0~-1.3 V (vs. RHE)电势下可形成CO/H2近似为1/3的合成气, 在-0.9 V (vs. RHE)的电势下可形成CO/H2近似为1/4的合成气, 而且CO和H2的总法拉第效率高达84%。催化剂CuO/ZnO-3(图6(e))也显示出类似于催化剂CuO/ ZnO-2的结果。以上实验结果表明: 通过调控催化剂中的化学组分及其含量或者应用电势可以可控制备不同CO/H2比值的合成气, 这是由于Zn物种更有助于析出氢气[26], 从而导致CO/H2的比值发生改变。催化剂CuO/ZnO-2的循环稳定性结果如图6(f)所示, 经过6次循环测试之后, 催化剂的电流强度较稳定, 但是产物CO和H2的选择性有所变化。从稳定性测试之后催化剂CuO/ZnO-2的TEM照片(图S3)发现, 催化剂在循环测试之后变成了空心结构, 这可能与CO2还原产物的选择性变化有关。
图6
图6
(a) CuO/ZnO-2催化剂在CO2饱和的KOH溶液(CO2-KOH)和N2饱和的KHCO3溶液(N2-KHCO3)中CO2的还原活性; (b) CuO、(c) CuO/ZnO-1、(d) CuO/ZnO-2和(e) CuO/ZnO-3催化CO2还原产物的法拉第效率及对应的CO/H2的直方图; (f) CuO/ZnO-2的循环稳定性(黑色方形: H2法拉第效率, 红色圆点: CO法拉第效率)
Fig. 6
(a) Reduction activity of CO2 in CO2-saturated KOH solution (CO2-KOH) and N2-saturated KHCO3 solution (N2-KHCO3); Histograms for FE of the CO2 reduction products and the ratios of CO/H2 for (b) CuO, (c) CuO/ZnO-1, (d) CuO/ZnO-2 and (e) CuO/ ZnO-3; (f) Cyclic stability of CuO/ZnO-2 (black square and red dot indicate Faraday efficiencies of H2 and CO, respectively)
Colorful figures are available on website
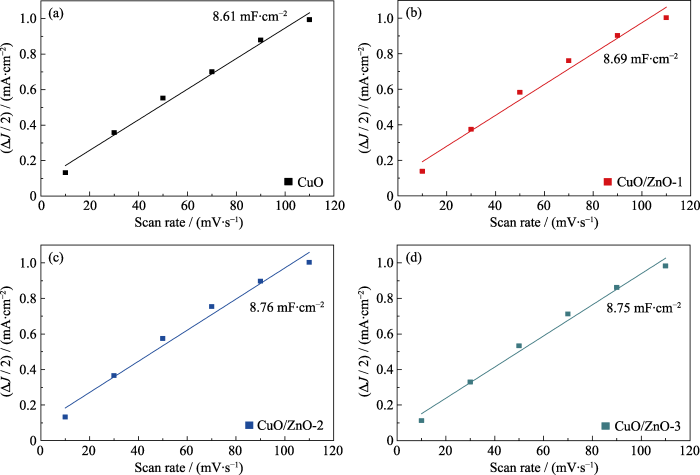
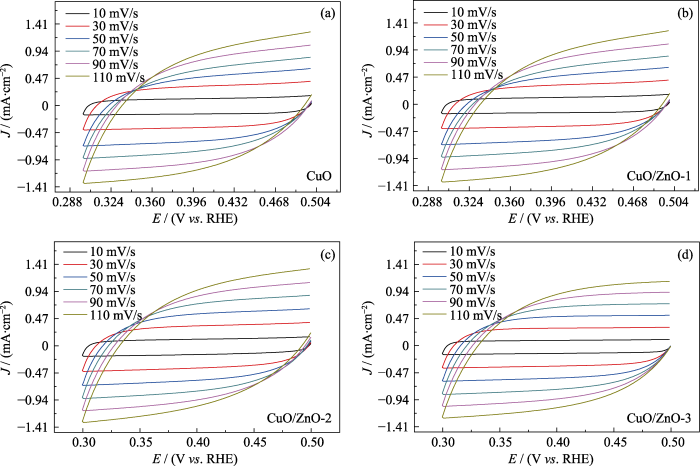
为了分析引入Zn物种对催化剂电化学活性的影响, 利用双层电容法估算CuO及CuO/ZnO催化剂的电化学活性比表面积。催化剂CuO及CuO/ZnO在10、30、50、70、90和110 mV/s扫描速率下的CV曲线如图S4(a~d)所示, 通过不同扫描速率下的循环伏安曲线得出不同催化剂的双层电容, 如图7(a~d)所示。研究发现: CuO、CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3催化剂的电化学活性比表面积分别为8.61、8.69、8.76和8.75 mF/cm2, 表明引入Zn物种几乎不会影响电化学活性比表面积。
图7
图7
(a) CuO、(b) CuO/ZnO-1、(c) CuO/ZnO-2和(d) CuO/ZnO-3电容ΔJ/2与扫描速率的线性拟合图
Fig. 7
Capacitive ΔJ/2 versus scan rate for (a) CuO, (b) CuO/ZnO-1, (c) CuO/ZnO-2, and (d) CuO/ZnO-3
Colorful figures are available on website
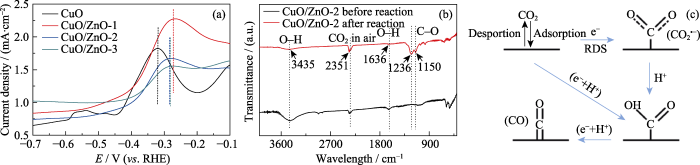
进一步分析催化剂中引入Zn物种对电催化CO2还原反应过程的影响。首先, 通过在0.1 mol/L KOH溶液中氧化LSV曲线探索催化过程中催化剂对中间物CO2•-的吸附能力[27], 结果如图8(a)所示。催化剂CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3的氧化峰电势相近, 说明CuO/ZnO对OH-有相似的吸附能力, 间接表明对CO2•-也具有相似的吸附能力。与CuO/ZnO相比, CuO的氧化峰电势更负, 说明CuO催化剂对CO2活化产物CO2•-的吸附能力较强。因此, CuO更有利于CO的形成, 而相比CuO催化剂, CuO/ZnO更倾向于产生H2, 在CuO中引入Zn物种成功实现了不同CO/H2比例合成气的调控。此外, 测试催化剂反应前后的红外光谱, 进一步分析其还原机理和途径, 如图8(b)所示。反应后2351 cm-1的峰明显变强, 说明CO2分子可以吸附在催化剂CuO/ ZnO-2的表面, 这是进行CO2还原的首要步骤。此外, 反应后的催化剂CuO/ZnO-2在1050~1350 cm-1之间出现明显的伸缩振动峰, 这归因于羧酸中C-O的振动[28,29]。以上结果表明, 催化剂在反应过程中形成了*COOH中间产物, 结合e-和H质子脱去水分子形成还原产物CO。通过催化剂的氧化LSV曲线和催化剂反应前后的红外光谱图, 提出了在催化反应体系中可能存在的反应机理, 如图8(c)所示。首先, 催化剂CuO中引入Zn物种之后, 催化剂表面吸附溶液中的CO2分子, 达到吸脱附平衡。然后, 经过催化剂活化后, 直线型CO2分子得到电子变成不稳定的弯曲型CO2分子(CO2•-)。活化后的CO2分子结合H质子形成*COOH中间物, 最终在质子和电子的作用下脱水形成CO产物[7]。在该体系中, CuO对活化产物CO2•-具有更强的吸附能力, 能够将活化后的CO2分子最终还原为CO产物, 是CO2还原的主要活性位点。而Zn物种引入后, CuO对CO2•-的吸附能力减弱。ZnO作为H2O还原的主要活性位点, 将H2O还原为H2。因此, 通过调控CuO中Zn的含量, 可以制备不同比例的CO/H2合成气。
图8
图8
(a) 在0.1 mol/L KOH溶液中, CuO、CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3的氧化LSV曲线; (b) CuO/ZnO-2催化剂反应前后的红外光谱图; (c) CO的形成示意图
Fig. 8
(a) Oxidation LSVs of CuO, CuO/ZnO-1, CuO/ZnO-2 and CuO/ZnO-3 in 0.1 mol/L KOH; (b) Infrared spectra of the CuO/ZnO-2 catalyst before and after reaction; (c) Schematic formation process of CO
Colorful figures are available on website
3 结论
本研究基于Cu基非贵金属材料, 采用金属离子共沉淀法制备了CuO和CuO/ZnO催化剂, 并应用于电化学CO2还原反应制备不同CO/H2比例的合成气。研究发现, CuO催化剂在-0.9和-1.3 V(vs. RHE)的电势下可以制备CO/H2为1/1和1/2的合成气。引入Zn物种得到的CuO/ZnO催化剂可以制备CO/ H2为1/3和1/4的合成气, 这是因为CuO/ZnO催化剂对中间物CO2•-的吸附强度减弱, 导致了H2的选择性增加。这种通过金属离子共沉淀法制备的Cu基催化剂成功实现了不同CO/H2的可控合成, 将为后续制备合成气的研究奠定基础。
补充材料
图S1
图S1
CuO、CuO/ZnO-1、CuO/ZnO-2和CuO/ZnO-3电催化剂的(a) N2吸脱附曲线和(b)孔径分布曲线
Fig. S1
(a) N2 adsorption/desorption curves and (b) pore size distributions of CuO, CuO/ZnO-1, CuO/ZnO-2 and CuO/ZnO-3 electrocatalysts
图S2
图S2
(a) CuO、(b) CuO/ZnO-2、(c) CuO/ZnO-2和(d) CuO/ZnO-3的电流-时间曲线
Fig. S2
i-t curves of (a) CuO, (b) CuO/ZnO-2, (c) CuO/ZnO-2 and (d) CuO/ZnO-3
图S3
图S3
催化剂CuO/ZnO-2循环稳定性测试后的TEM照片
Fig. S3
TEM image of catalyst CuO/ZnO-2 after cyclic stability test
图S4
图S4
(a) CuO、(b) CuO/ZnO-1、(c) CuO/ZnO-2和(d) CuO/ZnO-3在不同扫描速率下的CV曲线
Fig. S4
(a) CV curves for (a) CuO, (b) CuO/ZnO-1, (c) CuO/ZnO-2 and (d) CuO/ZnO-3 at different scan rates
参考文献
The development of cocatalysts for photoelectrochemical CO2 reduction
CO2 reduction: from the electrochemical to photochemical approach
Cocatalysts for selective photoreduction of CO2 into solar fuels
Interfacial engineering of graphitic carbon nitride (g-C3N4)-based metal sulfide heterojunction photocatalysts for energy conversion: a review
Carbon foam decorated with silver nanoparticles for electrochemical CO2 conversion
Promotion of CO2 electrochemical reduction via Cu nanodendrites
Tunable syngas production from CO2 and H2O in an aqueous photoelectrochemical cell
Decoupling strategy for enhanced syngas generation from photoelectrochemical CO2 reduction
Photoelectrochemical CO2 reduction into syngas with the metal/oxide interface
From low to high-index facets of noble metal nanocrystals: a way forward to enhance the performance of electrochemical CO2 reduction
Recent advances in noble metal- based nanocomposites for electrochemical reactions
Recent advances in noble metal (Pt, Ru, and Ir)-based electrocatalysts for efficient hydrogen evolution reaction
P-block metal-based (Sn, In, Bi, Pb) electrocatalysts for selective reduction of CO2 to formate
Noble metal- free catalysts supported on carbon for CO2 electrochemical reduction
H2 production via ammonia decomposition using non-noble metal catalysts: a review
Light-driven heterogeneous reduction of carbon dioxide: photocatalysts and photoelectrodes
The effects of currents and potentials on the selectivities of copper toward carbon dioxide electroreduction
Tunable syngas production through CO2 electroreduction on cobalt-carbon composite electrocatalyst
Efficient electrochemical production of syngas from CO2 and H2O by using a nanostructured Ag/g-C3N4 catalyst
Nickel and indium core-shell co-catalysts loaded silicon nanowire arrays for efficient photoelectrocatalytic reduction of CO2 to formate
Efficient solar-driven electrocatalytic CO2 reduction in a redox-medium-assisted system
p-n junctions based on CuO-decorated ZnO nanowires for ethanol sensing application
Three-dimensional ordered ZnO- CuO inverse opals toward low concentration acetone detection for exhaled breath sensing
Carbon-modified CuO/ZnO catalyst with high oxygen vacancy for CO2 hydrogenation to methanol
Synthesis of the 0D/3D CuO/ZnO heterojunction with enhanced photocatalytic activity
Inversely tuning the CO2 electroreduction and hydrogen evolution activity on metal oxide via heteroatom doping
Wavy SnO2 catalyzed simultaneous reinforcement of carbon dioxide adsorption and activation towards electrochemical conversion of CO2 to HCOOH
Enhanced anti-bacterial activities of ZnO nanoparticles and ZnO/ CuO nanocomposites synthesized using vaccinium arctostaphylos L. fruit extract