通讯作者: 李志强, 研究员. E-mail:lizhq@sjtu.edu.cn; 张 荻, 教授. E-mail:zhangdi@sjtu.edu.cn
作者简介: 徐 润(1991-), 男, 博士研究生. E-mail:x.r.my.mail@gmail.com
采用聚合物热解化学气相沉积(PP-CVD)法, 通过聚乙二醇(PEG)的原位热解提供碳源、柠檬酸(CA)和硝酸钴反应产生催化剂纳米粒子, 在微纳米级的片状铝粉基底上原位生长碳纳米管(CNTs)。通过实验和反应动力学建模研究了PP-CVD反应机理, 揭示了PEG热解气相成分和催化剂纳米粒子表面气-固反应对CNTs生长速率的影响规律。CO初始分压和反应温度提高, CNTs生长速率提高; H2初始分压和催化剂密度提高, CNTs生长速率降低。模型预测的CNTs平均长度随反应温度和反应时间的变化趋势符合实验结果。因此, 本研究为进一步优化CNTs/铝复合粉末制备工艺提供了新的理论依据。
The method of polymer pyrolysis chemical vapor deposition (PP-CVD) was used to
在复合材料领域, 碳纳米管(Carbon Nanotubes, CNTs)因其优异的力学和传导性能, 独特的结构和几何特征[ 1]而成为最有发展前景的新型纳米增强体之一[ 2, 3, 4, 5]。近年来, 以CNTs作为增强体, 铝等轻金属及其合金为基体的金属基复合材料(Metal Matrix Composites, MMCs)的研究发展迅速[ 6, 7]。目前, 粉末冶金是最为常用的CNT-MMCs制备技术路线, 根据其粉末复合方法可分为高能球磨[ 8, 9]、溶剂辅助分散[ 4]、分子水平混合[ 10]和化学气相沉积(CVD)法[ 11]等等。其中, CVD法是在金属基体中原位生成CNTs, 因此CNTs的结构完整性及其与基体的界面结合均优于其他方法。但是, CVD法通常需要从反应器外部引入乙炔、甲烷、氢气等可燃性气体, 这样既不安全, 又由于粉体堆积, 反应往往并不均匀。为了克服上述缺点, Cao[ 12]和Tang[ 13]等提出了一种改进的聚合物热解CVD(Polymer pyrolysis-CVD, PP-CVD)法, 即先在微纳米级的铝粉表面形成含有聚乙二醇(Polyeth-ylene glycol, PEG)、柠檬酸(Citric acid, CA)和硝酸钴(Co(NO3)2)的前驱物薄膜, 然后将其置入反应器中加热处理, 在铝粉表面原位合成催化剂纳米粒子, 并通过PEG的热解提供碳源, 成功地在铝粉表面合成了分布均匀、形貌良好、尺寸可控的CNTs, 为制备CNT/Al复合粉末提供了新的技术途径。
然而, 与传统CVD方法相比, PP-CVD反应过程复杂, PEG热解气体成分多样(包括CO、CO2、CH4、H2O、H2等), 各种气体的作用尚不明了。传统的CVD机制通常认为碳源在催化剂粒子一侧吸附并分解成表面活性碳原子, 然后扩散至另一侧形核并生长CNTs, 根据CNTs生长位置处于粒子顶端或底端而分为顶端生长机制或底端生长机制[ 14, 15]。Louchev等[ 16]基于碳原子在钴(Co)纳米粒子中的体扩散提出了碳纤维的扩散生长模型。Ma等[ 17]基于在Co粒子表面的气-固反应和扩散建立了CNTs的表面扩散生长模型。Chen等[ 18]则建立了Co纳米粒子表面形成无定形包覆碳的模型, 用以解释催化剂失活的现象。然而, PP-CVD的表面反应复杂, 各种气体分压随反应进行不断变化, 无法直接采用以上模型进行描述。本工作结合现有CNTs生长机制的研究成果, 拟建立PP-CVD生长CNTs的动力学模型。
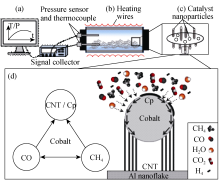
PP-CVD生长CNTs的过程在如图1所示的密闭反应器中进行, 规格为 φ40 mm×40 mm, 并配备温度和压力监测系统, 以便于对反应机制的研究。
复合粉末的合成工艺包括三个步骤:
(1) 前驱物溶液制备: 将0.75 g PEG(分子量: 1000)、2.5 g一水柠檬酸和1.25 g Co(NO3)2•5H2O和5 mL乙醇混合, 充分溶解后, 获得PEG:CA•H2O: Co(NO3)2•5H2O=0.6:2:1的前驱物溶液。
(2) 片状铝粉表面包覆前驱物薄膜: 向前驱物溶液中加入2.5 g铝粉, 充分搅拌后抽滤, 随后将所获得的包覆有PEG-CA-Co(II)前驱物薄膜的铝粉真空干燥。
(3) PP-CVD生长CNTs: 将包覆前驱物薄膜的片状铝粉置于密闭反应器中, 加热至403 K保温2 h, 随后加热到873 K, 在此温度下, 前驱物薄膜分解, CNTs开始生长, 在873 K下的保温时间为30 min或60 min。
采用扫描电子显微镜(Hitachi, S-4800 SEM)和透射电子显微镜(Philips CM200型TEM)表征CNTs的形貌和尺寸; 采用拉曼光谱仪(SENTERRA)表征CNTs的石墨化程度。使用气相色谱分析仪(GC, Agilent 6890 Plus GC)表征前驱物薄膜热解的气体成分。
参考CVD法中CNTs的生长机制来研究PP-CVD法中CNTs的生长, 碳源扩散机制为气相-表面-固相机制(图1(d)), 即生长过程包括:
(1) 气相成分在催化剂粒子一侧表面的吸附和分解;
(2) 活性碳原子在催化剂表面的扩散;
(3) 活性碳原子从催化剂粒子另一侧析出形成CNTs。
该生长模型没有考虑基底的作用, 而CNTs的生长模式主要取决于催化剂粒子和基底的结合强度[ 14, 15], 因此本文建立的模型不考虑基底的影响, 在PP-CVD方法中粒子以顶端或底端生长机制, 并不会影响模拟的结果。
模型中所使用的符号如表1所示。
| 表1 模型中使用的符号定义 Table 1 Nomenclature of the symbols used in the modeling |
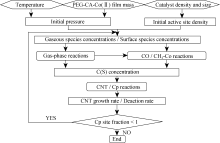
模型流程图如图2所示, 当催化剂粒子完全失活时, CNTs生长停止。反应模型使用CHEMKIN软件[ 19]中的密闭均相反应器(Closed Homogeneous Reactor)条件进行模拟。
根据NIST-JANAF热化学表[ 20]的数据, 在873 K的反应温度下, 在气相成分各种反应中, 仅CH4的高温分解反应有较高的反应速率。根据Coltrin[ 21]和Grujicic[ 14]等的研究, CH4分解反应途径为:
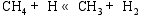
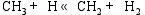
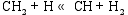
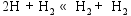
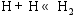
这些反应的正向反应速率常数和反向反应速率常数可由修正的Arrhenius公式(1)和(2)[ 22]计算得到。
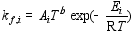 | (1) |
 | (2) |
各气体形成的吉布斯自由能来自于NIST-JANAF热化学表[ 20]。而各气体产生速率由方程(3)和(4)计算得到。
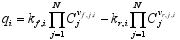 | (3) |
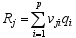 | (4) |
CNTs的气相-表面-固相生长机理理论研究[ 23, 24]表明, Co纳米粒子表面吸附CO和CH4并形成活性碳原子C(S), C(S)除参与表面反应外, 还会发生表面扩散生长CNTs, 或形成无定形包覆碳Cp。Cp一旦生成, 则占据催化剂表面活性位点, 使得催化剂的活性降低。一般来说, 假定在反应模型中每个Co纳米粒子都可以催化生长CNTs[ 25]。
发生在催化剂表面的反应可分为以下五类:
(1) 气体在催化剂表面活性点上的吸附/脱附作用[ 26]:

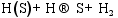
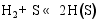
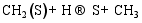

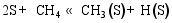
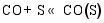
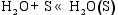
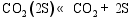
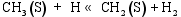
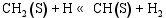
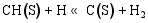
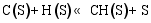
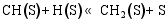
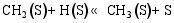
(3) CO的加氢和分解过程[ 26]:

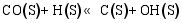
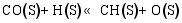
(4) H2O和CO2的表面反应[ 26]:
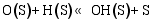
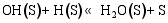
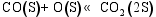
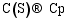
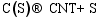
以上各项反应的Arrhenius修正公式中, 指前因子 A、温度修正系数 β和自由能 E均来自于参考文献。Puretzky等[ 28]认为, CNTs生长反应的Arrhenius修正公式指前因子由C(S)的表面扩散过程决定, 为 D0/ R2。根据Yokoyama等[ 29]的实验数据, 在873 K下, D0=10-5.09 m2/s, E=149 kJ/mol。根据CNTs的几何形态, 其生长的平均速率由公式(5)和(6)得到。
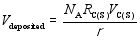 | (5) |
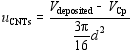 | (6) |
由热重分析[ 9]显示, 约700 K时PEG-CA-Co膜已经完全分解。基于气相色谱(GC)分析, 873 K下, PEG-CA-Co膜热解产生的气体主要包括CO2、CO、H2O、CH4和H2, 此时各气体分压即被作为反应初始分压, 如表2所示。其中, CO和CH4是CVD法中常用的CNTs生长碳源[ 17, 18, 30], 而H2、H2O、CO2则参与气相和表面反应。
| 表2 密闭反应器中PEG-CA-Co(II)热解气体组成 Table 2 Composition of the PEG-CA-Co(II) pyrolysis gases in the batch reactor |
如图1(c)所示, 模型中片状铝粉被简化为碟状, 上下两面都被球型的Co纳米粒子所覆盖。根据Tang等[ 13]的实验结果, 在本实验反应条件下, Co纳米粒子的直径约15 nm, 分布密度约为7×1010/cm2。根据Ma等[ 17]提出的简化CNTs模型(图1(d)), CNTs的外径等同于催化剂粒子直径, 而且内径为外径的一半。催化剂表面的活性点密度由Co纳米粒子表面区域与碳源气体分子(即在表3中列出的CH4、CO和 CO2)投射区域之比估算而来[ 17, 27]。
| 表3 纳米Co粒子表面区域与碳源气体分子投射区域比例 Table 3 The ratio of Co nanoparticle surface area to the projected area of carbon source gas molecules |
根据气相成分的投射区域之比, 近似认为每个CH4和CO分子占据一个活性点, 而一个CO2分子占据两个活性点。对于催化剂表面, 有如下活性点守恒方程:
[OH]+[H2O]+[CO(S)]+[CH(S)]+[CH2(S)]+[CH3(S)]+[C(S)]+[Cp]+[S]+2[CO2(2S)]+[O(S)]=[S0] (7)
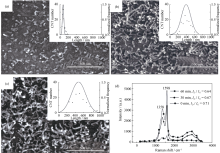
实验结果显示, 使用本实验的PP-CVD方法, 在片状铝粉(图3(a))表面包覆PEG: CA•H2O: Co(NO3)2•5H2O的比例为0.6: 2: 1的前驱物薄膜, 经过403 K保温2 h和873 K保温1 h的反应过程后, 片状铝粉表面生成了形态好、分散均匀的CNTs(图3b)。
TEM图像(图3(c))显示所合成的CNTs有较好的微观形貌, 图3(d)中的HRTEM图像表明, CNT具有较好的微观结构, 管壁清晰, 缺陷较少, 层数为10层左右, CNT横截面外径约15~20 nm。根据选区电子衍射标定结果, 图3(d)中中空的CNT中的颗粒为催化剂Co纳米粒子, 为密排六方型。
在控制其它变量的情况下, 反应中主要影响CNTs生长速率的因素包括前驱物比例(决定初始气体分压)、纳米Co粒子密度和反应温度。图4反映了模型中各项变量对于CNTs生长速率的影响。
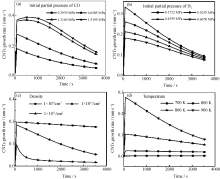 | 图4 模型中各项变量对于CNTs生长速率的影响(60 min内)Fig.4 Effects of different vatiables in the modeling on the CNT growth rates in 60 min |
在模型的假设条件下, 提高CO的初始分压有利于CNTs的生长, 而H2初始分压的提高不利于CNTs的生长。这意味着前驱物中CO的主要供体PEG[ 12]的含量提高有利于CNTs的生长。这在一定范围内符合Tang等[ 13]的实验结果。
由于反应体系中碳源有限, 随着纳米Co粒子分布密度的提高, 碳源消耗加快, CNTs生长速率降低。然而, 纳米Co粒子少意味着相同时间内总的CNTs生成数量低, 在原位CNT/铝复合材料中, 这是一个值得注意的因素。Tang等[ 13]的实验证明前驱物配方中PEG:CA•H2O: Co(NO3)2•5H2O为0.6:2:1时, 能够在单根CNTs尺寸和Co含量较低时, 大大提高CNTs的总生成数量, 这对于复合材料的制备是较优的配方比例。
在700~900 K的反应温度范围内, 反应温度的提高有利于CNTs的生长。考虑到铝基体的熔点(933.45 K)[ 20]和与Co的互扩散作用[ 31]对反应的影响, 并根据Tang等[ 13]的实验, 反应温度选在873 K左右为宜。
根据前述表面反应机制, 随着反应的进行, 在CNTs生长的同时, 气相成分在钴催化下不断消耗和转化。模拟得到的反应器中气体摩尔分数的随时间变化结果(图5)说明, CO、H2和H2O摩尔分数不断降低, 在反应中被消耗。因此, CO作为主要碳源提供CNTs和Cp生长所需的C(S), 而H2和H2O明显参与到表面反应中。
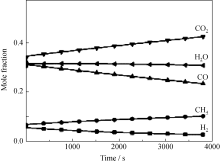 | 图5 873 K时反应器中气相成分的摩尔分数与反应时间的关系Fig. 5 Mole fraction of gaseous species in the batch reactor versus the growth time at 873 K |
图6显示了生长时间为0、30和60 min时CNTs的形貌、尺寸分布和拉曼光谱(生长时间指的是当温度升高到873 K后的保温时间)。在升温和降温过程中, 当温度超过700 K以后, CNTs就会开始生长, 因此保温时间为0 min, 即有短的CNTs生成(图4(a))。随着反应时间的延长, CNTs的平均长度持续增加。在约1598 cm-1处的拉曼光谱峰(G峰)表征CNTs中高度石墨化的部分, 而约1358 cm-1处的拉曼光谱峰(D峰)表征CNTs中的缺陷。由拉曼光谱显示, 反应60 min内, CNTs的晶化程度不断提高。873 K, 在片状铝粉表面原位生成CNTs长度随时间变化的模拟值和实验值的比较如图7所示。
通过比较可以发现, 两条曲线的变化趋势相近, 在较短的反应时间内匹配度较高。实验值和模拟值之间的差异可能由于利用SEM图像进行CNTs长度的统计, 量取的是电子在成像系统上的投影长度, 存在一定的误差。此外, 如PEG的不完全分解、催化剂粒子的团聚、铝基底对CNTs生长的影响、铝片的重叠等情况也会使得实际值略小于模拟值。如果反应模型将这些参数都纳入考虑, 模拟结果将更加准确。
实验值和模拟值在CNTs平均长度随时间变化的趋势上的匹配表明, 本模型和实际反应情况有较高的匹配性。模拟结果显示, CO在CNTs生长反应中是主要碳源, 而由于CH4和CO2生成C(S)的反应链复杂且反应速率不高, 在CO存在的情况下, 不仅作为碳源提供C(S)的效率很低, 还可能会由于CH4和CO2的生成消耗C(S)。CH4、H2O和H2表面反应生成为CO催化加氢过程提供H(S), 是CO生成C(S)的主要反应路线的一环。随着反应时间的延长, 一方面CO发生消耗, 另一方面催化剂粒子表面由于Cp的形成而不断失活, CNTs生成速率降低。
采用PP-CVD法在片状铝粉表面原位生成CNTs, 制备了CNT/Al复合粉末, 并针对密闭反应条件建立了PP-CVD反应动力学模型, 使用该模型研究了不同变量对于CNTs生长速率的影响, 通过CNTs长度-时间关系将模拟结果和实验结果进行了比较。实验和模拟结果说明:
1) PP-CVD法能在铝片基体上原位合成分布均匀、形貌良好的CNTs;
2) 模拟结果显示, CO初始分压和反应温度升高, CNTs反应速率提高; H2初始分压和催化剂密度提高, CNTs反应速率降低。这些变量的影响可以用于反应工艺的进一步优化;
3) 模拟预测的CNTs生长长度随时间的变化趋势与实验值匹配, 说明模型具有很好的可靠性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|