作者简介: 李 波(1980-), 男, 博士, 副教授. E-mail:leewave@126.com
磷酸钙微球具有良好的渗透性、高的比表面积、低致密度和较好的力学性能,在分离、催化、传感、组织工程和药物释放等方面均有应用。本文综述了近年来磷酸钙陶瓷微球在组织工程和药物释放等骨修复相关领域的研究进展, 介绍了实心、多孔、空心和花瓣状等四种不同结构磷酸钙陶瓷微球制备方法以及在骨修复领域中的应用, 并归纳总结了各类微球具有的优缺点和改进的方向, 为骨修复用磷酸钙微球的设计和制备提供较系统的参考。
Calcium phosphate ceramic microspheres have attracted many research interests in various application fields, such as separation, catalysis, sensor, tissue engineering and drug delivery, due to their excellent permeability, high surface area ratio, low density and stable mechanical properties. In this paper, current advances of calcium phosphate ceramic microspheres in bone regeneration applications, such as bone tissue engineering and anabolic drug delivery, were comprehensively reviewed. Calcium phosphate ceramic microspheres were classified into four main categories according to their solid, porous, hollow or flow-like structures. The corresponding preparation methods and specific applications were summarized. Advantages and disadvantages of such microspheres were evaluated and future improvements were proposed. This review is intended to provide a comprehensive guide to the design and fabrication of calcium phosphate microspheres aiming at repairing bone defects.
微球是生物材料领域一种重要的材料形式, 与常规形式的生物材料相比, 微球具有如下特点和性能[ 1]: 1)具有微/纳米尺寸的微球, 由于具有较小的尺寸和较大的比表面积, 已被广泛用作药物控释载体。2)通过微球表面修饰, 微球可以对环境温度、pH、磁场、超声、辐射等因素产生快速的响应。3)微球可以作为致孔剂, 提高传统块体支架材料的孔隙率, 有利于组织的长入, 同时改善材料的力学性能。4)微球作为微反应器, 诱导磷灰石在其表面矿化, 有利于骨组织再生。5)微球本身固有的球形属性使其具有良好的可注射性, 可用于微创治疗, 并在修复复杂部位的骨缺损时容易成型。6)在微球内制作较大直径的孔道, 使之可容纳细胞生存, 微球即为一种组织工程支架, 作为可注射支架材料应用于微创治疗[ 2, 3]。因此, 微球材料是目前生物材料领域发展较快以及应用前景较好的材料类型之一。
磷酸钙(Cacium Phosphate, CaP)为代表的无机生物陶瓷材料, 与自然骨中的无机成分相似, 有良好的生物活性和力学性能, 一定组成和结构的CaP陶瓷还具有骨诱导性, 广泛用于骨修复领域[ 4]。其中羟基磷灰石(Hydroxyapatite, HA)、磷酸三钙(Tricalcium Phosphate, TCP)及它们的复合物是研究最多的一类CaP陶瓷。目前, CaP陶瓷材料多以粉体和块体形式用于骨修复领域, 且有较长的研究历史, 大量的研究集中在CaP的粉体合成[ 5]和块体制备[ 6]及其生物学性能的研究上。而将CaP制备成微球和纳米球并用于生物医学领域却是近十年来才发展起来的, 研究报道并不多。根据文献检索, 我们发现有关单纯高分子微球或高分子/生物陶瓷复合微球的综述较多[ 7, 8], 而有关CaP、生物玻璃以及其它无机生物材料制备的微球, 作为生长因子和骨髓间充质细胞(MSCs)的载体用作骨修复材料, 则综述较少[ 9]。本文综述了近年来CaP微球制备方法及应用现状, 归纳总结了这些方法的优缺点, 可以为磷酸钙微球的设计和制备提供较系统性的参考。
早期制备的CaP微球多为实心, 由于粒径较大, 这种微球也叫作珠子(bead)。常用实心微球制备方法主要有喷雾干燥造粒法、溶胶-凝胶法和乳液法等, 较典型的CaP实心微球如图1所示。
 | 图1 几种典型的CaP陶瓷实心微球[ 10, 12, 13]Fig. 1 Images of typical calcium phosphate solid microspheres(a) β-TCP microsphere prepared with nitrogen liquid freeze drying method[ 10]; (b) HA microsphere prepared with CMCS and gel as binder[ 12]; (c) HA microsphere prepared with emulsion method[ 13] |
聚乙烯醇(PVA)具有良好的粘结性, 可以和陶瓷粉末混合成球。Matsuno等[ 10]以β-TCP为原料, 与PVA水溶液混合, 超声分散后滴入液氮, 经冷冻干燥后制得β-TCP球, 粒径在100~1000 μm。在另一项研究中, Hashimoto等[ 11]以β-TCP珠子作为一种可注射材料并可以控制其粒径范围。其中, 小鼠骨髓基质细胞(KUSA/A1)在500~700 μm的珠子上表现出更高的碱性磷酸酶(ALP)活性。而体内实验表明, 300~500 μm粒径范围的珠子有更好的骨修复能力, 说明体内外实验结果有一定的差异, 骨修复效果受微球直径的影响。
一些多糖和明胶也可用来粘结成型陶瓷微球。罗会涛等[ 12]以羧甲基壳聚糖(CMCS)和明胶(Gel)作为粘结剂, 以沉淀法制得的纳米羟基磷灰石浆料为原料, 采用溶胶-凝胶法制备出粒径分布均匀, 几何形态良好的致密HA球粒, 其孔隙率为(4.7± 0.6)%, 单粒抗压强度为(8.9±0.4) MPa(颗粒直径为0.5 mm); 孔隙率高于(16.4±0.5)%的多孔球抗压强度为(7.9±0.2) MPa。仿生矿化和细胞培养的结果显示致密HA球粒具有良好的生物学性能。为了提高HA在壳聚糖中的稳定性, Sunny等[ 13]将HA分散于壳聚糖水溶液中, 再滴入加有稳定剂的液体石蜡中, 以含戊二醛的甲苯溶液为交联剂, 通过solid-in- water-in-oil(S/W/O)乳液法制备了直径在125~1000 μm的微球。
α-TCP溶解性较强, 在一定的条件下可以转化为HA。Kamitakahara等[ 14]以水热处理α-TCP微球的方式得到了表面含有棒状缺钙型HA粒子的微球, 当浸泡在过饱和钙磷水溶液中其表面会形成亚微米的HA粒子。这种缺钙型的HA微球可用作骨修复用药物控释载体。α-TCP骨水泥滴入植物油中也可以乳化得到实心微球, 在骨水泥中加入胶原蛋白还可以提高微球注射性能及促使细胞增殖[ 15]。
CaP实心微球主要通过陶瓷粉末与有机物粘结剂混合成球, 再在高温下烧除有机物得到。实心微球虽然保持了CaP陶瓷良好的生物相容性和生物活性, 但较小的比表面积使其载细胞和载药能力都受到了限制。因此, 制备具有多孔结构的微球成为微球发展的方向。
在实心微球的基础上发展起来一种具有多孔结构的陶瓷微球。其表面丰富的多孔结构有利于营养物质的输送和药物存储与控释[ 16]。几种典型的多孔CaP陶瓷微球如图2所示。
海藻酸盐具有离子交联的特性, 将含有CaP粉体的海藻酸钠溶液滴入到一定浓度的氯化钙溶液中, 液滴因交联发生凝固从而制备出CaP微球。Bernhardt等[ 17]以含有HA粉末的海藻酸盐溶胶通过离子型凝胶作用成球, 再在650℃下烧除海藻酸盐得到表面有大孔结构的HA微球。Ribeiro等[ 18]以磷酸钛钙和HA为原料, 与海藻酸钠溶液混合后, 通过与Ca2+离子成胶, 采用挤出的方式成球, 在高温烧除有机物后得多孔微球。除此之外, 也可以添加其它具有粘结性有机物如聚己内酯[ 19], 具有挥发性有机物比如萘[ 20], 可溶性的盐如NaCl[ 21]作为致孔剂制备多孔微球。
粉料在通过喷雾干燥造粒时, 雾化后的稀料在与热空气的接触中水分会迅速汽化, 可得到干燥微球。Wang等[ 22]通过喷雾干燥后得到的颗粒经高温烧结制备了表面有多孔结构的HA微球。发现空气流速和补料速率对微球比表面积、尺寸分布有重要影响, 但对形貌、相组成结晶性无影响。并详细地考察了500~1100℃之间这种微球的烧结行为, 结果表明在500~600℃微球表面结构没有显著变化, 而超过800℃, 微球表面会产生开孔结构, 高于1100℃分散性会降低并产生团聚[ 23]。这种方法可以大规模制备多孔微球, 但表面结构不容易控制。
 | 图2 两种典型的多孔CaP微球[ 18, 23]Fig. 2 Two typical porous CaP microspheres[ 18, 23](a) HA microsphere prepared with alginate salt gel process[ 18], (b) HA microsphere prepared with spray drying method[ 23] |
表面多孔结构大大提高了陶瓷微球比表面积, 同时也提高了其载药和载细胞能力。但是, 作为细胞载体, 其内部相对实心的结构阻碍了细胞和药物进入微球内部, 因此有必要发展一种内部是空心结构的陶瓷微球[ 24]。
CaP空心微球可以通过生物玻璃微球[ 25]或碳酸钙微球[ 26]作为硬模板进行转化。典型的生物玻璃微球转化方法如图3所示, 大致过程是在硅酸四乙酯(TEOS)的水溶液中, 加入含钙、含磷或含锂等溶解性较高的原料, 以酸催化控制TEOS水解成凝胶, 干燥得粉末, 经高温熔融玻璃粉末后得到生物玻璃微球。以玻璃微球为模板, 在含有PO43-和OH-的溶液中通过离子交换得到CaP微球。在此过程中, Ca2+和其它离子会从玻璃中溶解释放出来, 而溶液中的PO43-和OH-会与Ca2+反应, 在玻璃微球表面形成无定形的磷酸钙(amorphous calcium phosphate, ACP), 玻璃内核持续溶解, 同时ACP转化成HA。最终得到表面具有纳米和微米级微孔且内部为空心或多孔结构的CaP陶瓷微球。
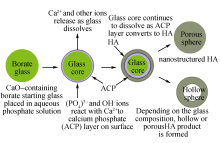 | 图3 以生物玻璃微球为硬模板的方式制备的CaP陶瓷空心微球工艺流程示意图[ 27]Fig. 3 Scheme of calcium phosphate hollow microsphere with bioglass as hard template[ 27] |
Fu[ 27]和Yao[ 28]等通过该种方法制备了一系列的CaP陶瓷空心微球, 并且详细地考察了玻璃向HA转化的影响因素。发现溶液pH(9~12)对微球微结构影响不大, K2HPO4溶液的浓度(0.01~0.25 mol/L)对壳层的厚度、比表面积和孔径有较大的影响; 而转化温度(25~60 ℃)既会影响壳层厚度也会影响微球表面孔径, 而对表面积影响不大。在较低温度和浓度条件下可以获得较大的空心内核, 而较高浓度下可以获得较大的比表面积和孔径。这种方法制备的HA陶瓷微球形貌如图4所示。
 | 图4 以玻璃微球为硬模板制备的空心CaP陶瓷时, 作为模板用玻璃微球形貌(a), 空心HA微球外表面形貌(b),空心HA表面放大形貌(c), HA空心微球抛光纵切面背散射SEM观察到的形貌(d), X射线能谱显示图片(d)的含P(e)和Ca(f)元素分布[ 27]Fig. 4 SEM images of hollow HA microsphere with glass as hard template. (a) starting glass microspheres as hard template, (b) external surface of hollow HA microsphere, (c) external surface of hollow HA microsphere at high magnification. (d) SEM image in back-scattered mode of a polished cross section of a hollow hydroxyapatite microsphere, (e) and (f) X-ray maps of Ca(K) and P(K) across the planar section shown in (d)[ 27] |
除了生物玻璃可以作为制备CaP陶瓷微球的硬模板外, 碳酸钙也可作为一种硬模板。Guo等[ 29, 30, 31]通过碳酸钙微球作为模板制备了一系列碳酸化的HA微球, 其大体方法是通过水热法在碳酸钙微球表面形成碳酸化的羟基磷灰石, 再经过化学浸蚀的方法除去碳酸钙模板。这种微球具有空心的内核, 而核壳上具有微孔结构, 其微观结构主要是片状碳酸化的羟基磷灰石晶粒。在另一项研究中, Lin等[ 32]以CaCO3/Fe3O4为硬模板, 通过水热处理制备了梯度多孔空心磁性微球, 其磁性能可以通过Fe3O4的含量来调节, 并且还可以通过溶液pH来调控微球的药物控释曲线。
与生物玻璃和碳酸钙等硬模板相对的是一种生物软模板。Huang等[ 33]以酵母菌为生物模板, 通过聚二烯丙基二甲基氯化铵(Poly(diallyldimethylam-monium chloride))和聚丙烯酸(Polyacrylic acid, PAA)处理细菌表面, 然后采用层层自装组的形式在细菌表面沉积钙磷, 再在高温下烧除有机物, 得到空心结构的CaP微球。
乳液法由于使用了较易挥发的有机溶剂, 也容易制备空心结构的CaP微球。通常需要粘结剂, 如PVA或聚乙烯缩丁醛(poly(vinyl butyral, PVB))与CaP陶瓷粉末混合保持结构的稳定性, 通过乳化或喷雾干燥形成球状, 再经过高温热处理除去粘结剂, 烧结成瓷后得到陶瓷微球。Lee等[ 34]以PVB为粘结剂, 以二氯甲烷(DCM)为有机相, 以含PVA水溶液为无机相, 采用乳化法制得表面有一个大孔的空心CaP微球。
除此之外, 化学致孔、喷雾干燥, 水热法和电喷涂等方法也能用于制备空心CaP微球。Sun等[ 35]以改良的喷雾干燥方法, 制备了一种多孔空心HA微球。其大体方法是通过NH4HCO3在喷雾干燥的过程中分解产生CO2和NH3的方法致孔, 通过NH4HCO3含量可以控制孔结构。在Jiao等[ 36]的研究中, 同样以NH4HCO3作为致孔剂, 采用离心喷雾干燥的方法制备了空心的HA微球。
Wang等[ 37]以微波水热法制备了HA微球, 以Ca (CH3COO)2、Na2HPO4、NaH2PO4和柠檬酸钠为原料。结果显示所制得的微球是由纳米片状结构自装组而成, 表面具有纳米多孔及网状结构。这种空心微球在药物控释方面有潜在的应用。Eltohamy等[ 38]以电喷涂的方法, 制备了一种开口的TCP空心微球, 其方法是将Ca/P为1.5的CaP与聚乙烯吡咯烷酮乙醇溶液混合形成溶胶-凝胶前驱体, 通过电场控制喷嘴喷出速度得到微球, 800~1100℃高温烧除有机物制得开口β-TCP空心微球, 可用于抗生素控释。
空心CaP陶瓷微球较实心微球在细胞传导和药物控释方面表现出更优的性能。这类空心微球由于丰富的介孔结构和空心结构导致了较大的比表面积, 加上CaP的羟基与药物的羟基之间存在氢键作用, 因而具有较高的载药率和较长的控释时间, 表明了这种微球材料在骨修复方面有潜在的应用。但是如何保持空心结构并优化设计表面的多孔结构, 构建细胞能通过孔道进入空心内部的微球支架材料成为了空心微球的发展方向。常见的空心微球如图5所示。
 | 图5 分别以(a) CaCO3/Fe3O4硬模板法[ 32]、(b)酵母菌生物模板法[ 33]、(c) DCM乳液法[ 34]、(d) 喷雾干燥法[ 35]、(e) 微波水热法[ 37]、和(f) 电喷涂法[ 38]制备的几种典型的空心CaP陶瓷微球Fig. 5 Six typical hollow calcium phosphate microspheres prepared with (a) CaCO3/Fe3O4 as hard template[ 32], (b) yeast as bio- template[ 33], (c) DCM emulsion method[ 34], (d) spray drying method[ 35], (e) microwave-hydrothermal method[ 37], and (f) electrosprayed method[ 38], respectively |
这类微球一般通过水热法制备HA晶粒时形成。在高分子模板的作用下, 纳米片状HA晶粒会自组装形成的一种类似于花瓣的微球, 其典型结构如图6所示。
 | 图6 4种典型的花瓣状CaP陶瓷微球SEM照片, 分别是以 (a) 酒石酸氢钾[ 39]、(b) EDTA[ 40]、(c) 氟取代结合EDTA[ 41]和(d) 柠檬酸[ 42]等为模板制备而成Fig. 6 Four typical flower-like microspheres prepared with potassium hydrogen tartrate (a)[ 39], EDTA[ 40] (b), F- substitution combined with EDTA (c) and citric acid[ 41] (d) as template, respectively[ 42] |
Ma[ 39]以酒石酸氢钾作为模板通过水热法制备出一种由纳米片状HA晶粒自组装的花瓣状微球, 他分析酒石酸氢钾的螯合机制起到了关键的作用。
Kang等[ 40]以EDTA为模板, 分别以Ca(NO3)2ּ4H2O和KH2PO4为钙源和磷源, 以NaOH调节反应pH, 100℃反应8 h, 过滤水洗, 600℃热处理1 h后得到花瓣状HA球。在另一项研究中, Wang等[ 41]在该反应体系中加入F-, 制备了一种新颖的氟取代羟基磷灰石(FHA)花瓣状微球。
Yang等[ 42]利用柠檬酸(Citric acid, Ct)作为模板, 系统地研究了在水热条件下, 柠檬酸调控HA晶粒的生长特性, 通过控制Ca/P、Ca/Ct及pH能够得到不同结构的花瓣状微球, 并可用于药物控释[ 43]。图7给出了可能的机理解释[ 42, 44]: 当最初的pH较低时,首先生成的是CaCt-,随着反应时间延长,由于其分解速率比结晶速率要低,会形成大的盘状的CaCt-晶体,超过12h会完全转化成HA。当pH处于5.5-7.2,产物为微球,部分为哑铃形的微球。继续增大pH会形成松散的团聚体,pH超过7.4,纳米粒子会形成无规则的团聚体。他们推断最初的pH会影响结晶速率从而控制产物的形貌。另一方面,在不同的pH条件下,柠檬酸根会呈现不同的状态,比如Ct3-,HCt2-和H2Ct-等,这些不同的状态的柠檬酸根会吸附在结晶产物表面从而影响产物的表面电荷导致不同形貌的团聚体。当吸附速率比结晶速率低时,晶体会随机形成团聚体,最终产物也不具有规则形貌, 意味着pH和Ca/Ct共同决定了微球形貌。
 | 图7 以柠檬酸为模板制备CaP陶瓷微球随pH和Ct/Ca比值的形态变化图谱[ 42]Fig. 7 Morphology variation of HA crystals from solution at different pH and Ct/Ca mole ratio[ 42] |
相比于前面几种微球, 花瓣状微球粒径更小, 比表面积更大, 在药物控释方面具有独特的优势。
CaP陶瓷微球在骨修复和药物控释领域都有应用, 相比于块体陶瓷, 微球具有更好的可塑性和可注射性, 并可自下而上(bottom-up)地构建工程化骨组织。
实心微球可堆积形成多孔支架, Peng等[ 45]将致密HA微球和多孔管状HA支架结合设计成骨修复体(如图8所示)。微球之间的空隙形成贯通性良好的多孔结构, 并且可以通过球体直径大小调节孔隙率和孔径大小。在随后的狗体内植入实验中, 这种微球支架材料相比于常规的多孔支架材料表现出更优的骨诱导性能, 其可能原因是微球支架材料的分级多孔结构不但为组织长入提供了足够的空间, 并且有利于血管化及骨再生, 为承重骨修复材料的设计提供了参考[ 46]。粒径处于微/纳米范围的微球还可以和宏观多孔致孔方法结合制备成微观是微球结构、宏观是有多孔结构的支架材料[ 47]。
多孔、空心和花瓣状微球可以作为良好的药物控释载体。Lee等[ 48]发现多孔HA可以控释治疗骨质疏松的药物阿仑磷酸钠(alendronate)和生长因子BMP-2。Sun等[ 49]通过喷雾干燥制备了空心HA微球, 并用于控释胰岛素。相比于实心微球, 纳米尺寸的多孔HA空心微球大大提高了载药率, 并且阿霉素(DOX)释放量提高了2.5倍, 且具有pH敏感性, 是一种有潜力且具有高生物相容性的药物控释载体[ 50]。花瓣状微球具有较高的比表面积, 还可以通过掺入微量元素如Si和Sr等调控微球形貌, 微量元素的掺入可以增加载药量[ 51], 并且释放的微量元素还可以起到药用作用[ 52]。
空心微球可以作为一种良好的细胞载体, 体内兔颅骨6周修复表明该种微球具有较好的成骨修复能力[ 53]。在另一项研究中[ 54], 这种微球作为MSCs的载体, 修复兔颅骨6 mm缺损。12周组织切片表明, 相比于不加MSC, 空心微球加载MSCs起到了更好的修复效果。
 | 图8 HA微球与管状多孔HA支架及多孔圆片构建骨修复体(a)和腹膜植入(b)[ 45], 肌内植入3个月(c)后甲苯胺蓝染色组织切片[ 46]Fig. 8 Images of (a) the HA spherules, porous HA tubes, and HA disks fabricated to assemble the novel scaffolds, (b) digital photo shows the implantation of the porous scaffolds at peritoneum pocket[ 45], (c) photographs of toluidine blue stained spherulite HA-positive assemble scaffold after intramuscular implantation for 3 months[ 46]. NB represents new bone |
表面有微孔的空心微球是一种有效的生长因子控释载体。微球控释TGF-β[ 55]可用于修复大鼠颅骨, 6周后组织切片显示控释TGF-β的微球材料比没添加TGF-β材料组显示更好的修复能力。在另一项研究中[ 56], 还利用空心微球控释了BMP2, 为了降低缓释速度, 他们还采用了PLGA包裹。体外释放实验表明PLGA包裹的微球材料降低了缓释速度, 但体内实验表明50 mg/mL PLGA包裹控释骨形态蛋白2(BMP2)的微球比250 mg/mL PLGA包裹的微球显示了更强的颅骨修复能力。说明浓度过高的PLGA的缓慢降解阻碍了BMP2的释放, 使其没有达到成骨的有效浓度。在图9中, HE染色表明了载BMP2陶瓷微球相比空白微球起到了更好的骨修复效果。
CaP陶瓷微球可以通过表面修饰以提高其骨再生功能, 并可应用于诊断治疗。Green等[ 57]发展了RGD修饰的碳酸钙微球, 可以刺激MSC矿化并在体内表现出良好的骨再生性能。Wu等[ 58]将异硫氰酸荧光素(fluorescein isothiocyanate, FITC)成功地结合在单分散中空纳米微球表面, 实现了乳腺癌细胞(BT-20)的生物显影, 这种基于HA的纳米显影剂表现出较高的生物相容性, 展现了CaP材料生物显影方面独特的优势。CaP微球还可以和其它材料结合, 比如和金属材料结合。为了提高钛合金的生物活性, Kimura等[ 59]用HF化学腐蚀改性金属表面, 再将陶瓷微球与Hanks溶液混合, 通过高温热处理形成微球表面涂层。Fu等[ 60]进一步改良了微球结构和组成, 并用于制备钛合金涂层。他们将喷雾干燥制备的HA微球包裹一层CaCO3, 然后再包裹一层Ti粉, 采用等离子喷涂的方法在钛合金表面制备了梯度多孔涂层, 既有100~300 μm贯通性的大孔, 又有100 nm的微孔。这种微球为原料的梯度涂层结构有效地改善了钛合金的弹性模量, 并提高了骨界面结合能力。
Fu等[ 61]为了增强药物的缓释时间, 将空心陶瓷微球可以和PEG水凝胶结合。并且比较了BSA在PBS溶液中[ 62]和在PEG水凝胶中释放机制的差异。相同的HA空心微球, 在BSA释放到PEG中开始较慢, 而在后期BSA释放到PEG中和PBS中的量相当。他们分析微球用于药物释放, 在溶液中药物的扩散主要是由介孔壳层结构和药物从孔表面解吸附控制, 并且药物释放机制与其分子量及化学组成均相关。因此, 可通过表面包裹可降解高分子的方法延长释放时间和控制释放速度。总之, 将CaP陶瓷微球与其它材料组合会大大提高其应用的广泛性。
微球已经在骨组织工程中探索应用了几十年, 但是具有纳米和空心多孔结构微球近十年来才出现。CaP微球具有良好的单分散性, 可控的粒径分布及多孔性能等特点, 可作为可注射骨修复材料, 其在体内外表现出良好的细胞黏附、增殖和骨再生性能。尽管CaP陶瓷微球制备成本较低, 且有良好的生物学性能, 但是陶瓷微/纳米微球仍然还不能广泛应用于临床。其最大的困难在于难于控制其降解速率, 并且陶瓷基体与蛋白之间存在较高的亲和性, 作为药物载体时可能使吸附上的蛋白变性。
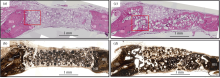 | 图9 空心CaP陶瓷微球修复大鼠颅骨6w后HE染色(a, c)和von Koss染色(b, d)组织切片, 其中(a, b)为空白对照微球, (c, d)为载1 μg BMP2微球[ 56]Fig. 9 (a, c) H&E and (b, d) von Kossa stained sections of rat calvarial defects implanted for 6 weeks with (a, b) as-prepared hollow HA microspheres (without BMP2) and (c, d) hollow HA microspheres loaded with BMP2 (1 μg per defect). HB represents host (old) bone; NB represents new bone[ 56] |
但是, 微球可以作为单分散相而被连续相包裹, 比如固态高分子, 水凝胶和骨水泥, 或者通过自下而上的方式形成块体多孔支架。与传统单一的支架材料相比, 由具有微米和纳米结构的微球构建的支架材料在诸多方面表面出更优的性能。因此, 制备具有形态、微纳米结构和多孔结构可控的微球, 并与高分子、水凝胶或骨水泥等材料结合使得磷酸钙陶瓷微球依然在骨修复领域中具有良好的应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|


