作者简介: 谭 英(1988-), 女, 硕士研究生. E-mail:tanying223@163.com
通过多巴胺自聚合在钛表面构建了仿生聚多巴胺(PDA)膜层, 有利于类骨羟基磷灰石在钛表面的沉积, 体现了良好的生物活性。利用聚多巴胺的螯合效应及还原性, 将纳米银颗粒载入聚多巴胺修饰钛表面; 利用场发射扫描电镜(FE-SEM)、X射线光电子能谱(XPS)、显微激光拉曼光谱(Raman)和石墨炉原子吸收光谱(GF-AA5)对聚多巴胺/纳米银修饰钛表面的银粒径、含量及离子释放进行表征。采用杀菌率和表面细菌粘附对聚多巴胺/纳米银修饰钛表面的体外抗菌性能进行检测, 研究结果表明: 纳米银对金黄色葡萄球菌具有较强的杀菌能力, 且MC3T3-E1细胞早期粘附和增殖结果证实本研究得到的聚多巴胺/纳米银修饰钛表面具有良好的体外细胞相容性。
A bioinspired polydopamine (PDA) layer was deposited on titanium surface by simply dipping the substrate into an alkaline dopamine solution. The in vitrobioactivity of the polydopamine coated titanium was assessed by incubation in simulated body fluids (SBF). The results showed that surface-anchored catecholamine moieties in polydopamine enriched the interface with calcium ions, facilitating the deposition of hydroxyapatite. Silver nanoparticles (AgNPs) were metallised on the PDA-grafted titanium surface in mild aqueous environments. About 14% silver release as Ag+ ions were found after 5 d when the surfaces were exposed to deionized water. The AgNPs showed an efficient microbicidal activity against Staphylococcus Aureus bacterial strains, while not significantly affecting osteoblast cells (MC3T3-E1) viability.
钛及其合金作为骨齿科硬组织替换材料, 植入体内后的细菌感染是其植入失败的主要原因之一。纳米银因其极大的比表面积, 较强的渗透性等特点成为抗菌材料的研究热点。然而, 鉴于纳米银潜在的细胞毒性, 提高纳米银修饰钛表面的细胞相容性和成骨活性具有重要意义。类生物组织膜的构建可以使材料避开免疫排斥反应和巨噬细胞的攻击, 提高材料的生物相容性, 此外, 表面的活性识别位点可供细胞和分子产生特异性响应[1]。Qu等[2]通过溶胶-凝胶法在钛表面制得含纳米银的类骨羟基磷灰石涂层, Giglio等[3]通过电聚合将水凝胶仿生涂层引入钛表面, 然后浸入到纳米银的悬浮液中得到纳米银/水凝胶复合涂层, 两者结果均证明复合涂层具有较高的抗菌率的同时具有良好的生物活性。目前, 仿贻贝粘连蛋白的聚多巴胺(PDA)因其具有极强的粘附性, 能够在各种基质上自聚成膜[4], 提高材料表面亲水性和生物相容性[5]等特点而广泛用于生物材料表面修饰。Xu等[6]还证实聚多巴胺能够显著增强活性陶瓷的生物活性, 有利于成骨细胞的增殖、分化和基因表达。此外, 聚多巴胺具有一定的还原性, 能够实现材料表面的无电金属化, 如Ball等[7]将聚多巴胺改性后的聚苯乙烯培养皿浸入硝酸银溶液中, 表面得到纳米银层, 证实其具有良好的抗菌性能。本研究利用多巴胺自聚合在钛表面构建出仿生聚多巴胺层, 测试了聚多巴胺层的体外生物活性; 利用聚多巴胺的金属离子络合作用和还原能力, 在钛表面制备出聚多巴胺/纳米银复合膜层, 并对其进行体外抗菌性能和细胞相容性研究, 旨在得到兼具良好生物活性和抗菌性能的钛基植入材料。
医用纯钛片用HNO3/HF溶液预处理后浸入60℃ piranha溶液( 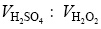
将实验1.1中制得的Ti-PDA样品浸入到20 mmol/L的硝酸银溶液中反应1 h, 后用去离子水反复清洗, 氮气吹干, 得到聚多巴胺/纳米银修饰钛样品(Ti-PDA -Ag)。为了检验纳米银修饰钛表面银离子的释放, 将1 cm2大小的Ti-PDA-Ag样品浸入到去离子水中, 37 ℃恒温振荡一定时间(6 h、12 h、1 d、2 d、3 d、5 d)后, 更换去离子水, 通过石墨炉原子吸收光谱仪(Z-5000, Hitachi, Japan)测定更换液中的Ag+浓度, 平行3次测量。
采用荷兰FEI公司Nova NanoSEM430扫描电镜观察样品表面的微观形貌; 通过德国Zeiss公司的DIGIDROP型接触角测定仪测试样品表面亲水性, 测量温度为25℃, 平行测量5次; 采用德国Bruker公司Vector33型傅里叶变换衰减全反射红外光谱仪分析矿化后样品表面的沉积物, 分辨率为4 cm-1; 采用美国Thermo公司ESCALAB 250型光电子能谱仪分析样品表面化学组成, 以单色AlKα 射线(15 kV, 150 W, hν =1486.6 eV)进行测定, 用C1s 结合能(284.8 eV)为标准进行能量校正; 样品表面的拉曼光谱通过法国HJY 公司的LabRAM Aramis型显微激光拉曼光谱仪(λ =532 nm)进行分析。
以金黄色葡萄球菌(ATCC 25923)为试验株检验钛表面的抗菌性能, 操作如下: 将ϕ 1 cm的钛样品置于48孔培养皿中, 用无菌移液管移取 1 mL金黄色葡萄球菌菌悬液(106CFU/mL)于样品表面, 在37 ℃生化培养箱中共培养24 h后, 利用倒平板法计算菌落总数, 以Ti为对照组, 杀菌率(R%)按下式进行计算:
 |
样品表面细菌粘附实验操作如下: 按照上述步骤将共培养6 h的样品浸泡到无菌PBS溶液(pH=7.4)中洗去未粘附的细菌, 戊二醛固定, PBS清洗后用梯度浓度的乙醇脱水, CO2临界点干燥后喷金置于扫描电镜(Nova NanoSEM430, FEI, Netherlands)下观察。
将Ti、pTi、Ti-PDA和Ti-PDA-Ag四组样品分别置于48孔培养板中, 移取500 μ L小鼠MC3T3- E1(ATCC CRL-2593)细胞悬液以2× 104 cells/mL浓度接种到48孔板中, 置于37 ℃、5% CO2细胞培养箱内培养12 h, 按照实验1.4中方法固定、脱水、干燥, 置于电镜下观察材料表面细胞的粘附。
四组样品按照上述步骤培养1 d、3 d、5 d和7 d后, 吸弃旧培养基, PBS 清洗后每孔加入300 μ L新鲜培养基和30 μ L溴化-3-(4, 5-2甲基噻唑基-2)-2, 5-二苯基四唑(MTT)溶液, 孵育3 h后轻轻吹打混匀, 用酶标仪(Multiskan FC, Thermo Scientific, America)在490 nm波长下测定OD值, 以样品Ti作为对照样。采用SPSS15.0统计学软件对四组样品的吸光度值进行处理。
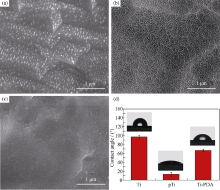
研究表明, 羟基化表面因其可以与聚多巴胺中的邻苯二酚基团发生脱水形成双齿类配位体[9], 增强聚多巴胺在表面的粘附。本研究通过piranha溶液处理酸洗钛表面, 一方面活化钛表面使其富含羟基, 另一方面使钛表面纳米结构化, 增强聚多巴胺层的结合力。图1 是聚多巴胺接枝前后钛表面的微观形貌和水的接触角对比分析。HNO3/HF酸处理后钛表面为亚微米台阶形貌, 台阶边缘高度约为0.2~1 μ m, 表面均匀分布HF刻蚀形成的纳米突起; piranha氧化处理后(图1(b)), 材料表面形成以纳米针结构为特征的不规则网络形貌; 多巴胺发生自聚合后, 在纳米网结构的钛表面构建出均匀颗粒状的仿生PDA膜层。Zhang等[10]已证实多巴胺在碱性条件下先经过一系列复杂的环化、氧化作用和分子内重排反应, 形成聚多巴胺的纳米颗粒, 溶液中的聚多巴胺纳米颗粒吸附在材料表面, 形成聚多巴胺单分子层。由此可以推断, Ti-PDA表面的纳米颗粒为聚多巴胺。固体材料表面的亲水性与其表面形貌和成分密切相关, 由图1(d)可知, piranha溶液处理后, 钛表面的水接触角由未处理样的(97.5° ± 3.0° )减小到(13.3° ± 4.4° ), 这是因为piranha氧化液可在钛表面形成一层富含Ti-OH基团的非晶态TiO2, 导致亲水性和表面自由能显著增加; 聚多巴胺修饰后, 钛表面水接触角为(66.9° ± 2.9° ), 一方面证实了聚多巴胺因含有大量的酚羟基和含氮基团而具有亲水性, 另一方面水接触角的变化间接证实聚多巴胺层均匀覆盖在纳米结构化钛表面。
 | 图1 酸处理钛(a)、纳米结构化钛(b)和聚多巴胺修饰钛(c)表面的扫描电镜照片及水的接触角(d)Fig. 1 SEM images (a-c) and water contact angle (d) of Ti (a), pTi (b) and Ti-PDA(c) |
目前多巴胺自聚合形成的聚多巴胺薄膜的精细结构尚不清楚, 但普遍认为其分子末端含丰富的酚羟基和醌基, 能够在矿化液环境中吸附Ca2+形成不可逆的有机金属络合物[11], 其进一步吸附溶液中的PO43-, 使羟基磷灰石牢固沉积在聚多巴胺薄膜表面, 体现良好的生物活性。Ryu等[12]利用超声和剥离实验证实, 聚多巴胺仿生沉积的羟基磷灰石涂层具有较强的结合力。图2是酸处理钛、纳米结构化钛及聚多巴胺自组装钛表面矿化5d后的电镜照片和红外结果。由图可知, 相较Ti, pTi和Ti-PDA表面均有白色沉淀物沉积, 且pTi表面为不规则的絮状团聚物, 没有特定形貌, Ca/P为1.1, 可能为磷灰石的初期形核物; Ti-PDA样品表面的沉积物呈半球状, 且表面为片状形貌, 为典型的类骨磷灰石形貌, Ca/P为1.4, 接近人体骨中的比值。
 | 图2 钛样品在模拟体液中矿化5 d后的电镜照片、能谱和红外图谱Fig. 2 SEM images, EDS spectra (a-c) and FTIR spectra (d) of Ti (a), pTi (b) and Ti-PDA (c) after 5 d in simulated body fluid |
图2(d)为pTi和Ti-PDA样品矿化5 d后的红外图谱。其中574 cm-1和602 cm-1附近是PO43-的P-O键的弯曲振动引起的吸收峰[12]; 1032 cm-1附近的吸收谱归属于PO43-; 626 cm-1、1620 cm-1和3350 cm-1附近的吸收峰是OH-的特征谱带, 这些特征谱带进一步证实了矿化后得到的产物为羟基磷灰石(HA), 且1032 cm-1附近的吸收峰较宽, 没有分裂为多个峰, 说明沉积的是无定型HA[13]。从红外图谱中还可以看出产物中基本不含其他杂质离子, 但是在873 cm-1和1400~1500 cm-1出现CO32-特征谱带, 且1400~ 1500 cm-1分裂成两个吸收峰, 它区别于碳酸盐的单峰, 是CO32-进入磷灰石结构的重要标志, 说明本研究矿化形成的HA中的部分PO43-被CO32-取代[14]。已有研究证实, 自然骨中磷灰石呈针状纳米晶体结构, 含以碳酸根为主的无机离子[15], 因此仿自然骨的含碳酸根的羟基磷灰石的沉积体现了聚多巴胺修饰钛表面良好的成骨活性。
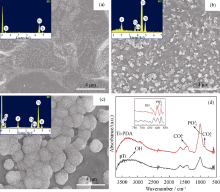
纳米银含量、形状及尺寸等对材料的抗菌性能有着重要的影响, Castanon等[16]证明, 较小粒径的纳米银具有更强的杀菌能力, 其原因是小粒径的纳米银比表面积更大, 更容易穿透细菌的细胞壁。图3(a)为Ti-PDA-Ag表面的SEM照片及利用Image J图像软件统计的该表面纳米银颗粒的粒径结果。研究结果表明, 纳米银呈球形颗粒状, 尺寸均匀, 平均粒径为(16.4± 2.6) nm。图3(b)的XPS显示, XPS宽谱中400 eV左右出现一个较强的N 1s峰, 归属于PDA, XPS 定量结果计算其表面O/C比值为 0.32, 与PDA 结构理论值0.25较为接近, 说明PDA成功自聚合在纳米结构化钛表面。结合能约为370 eV处有两个很强的Ag 3d峰, 分别对应Ag03d5/2(368.0 eV)和Ag03d3/2(374.0 eV)[17], 说明纳米银沉积在Ti-PDA表面, 且以银单质形式存在, 证明聚多巴胺层具有一定的还原性。XPS 定量结果显示银元素所占的原子百分比含量为0.37%, 说明钛表面仍富含大量的酚羟基和醌基等活性基团, 且Saidin等[18]证实, 聚多巴胺固定纳米银颗粒之后(银元素所占原子百分比为0.2%), 仍能较好地诱导羟基磷灰石在其表面沉积, 因此可以推测, 本研究得到聚多巴胺/纳米银复合膜层将具有较好的生物活性。
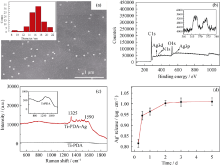 | 图3 聚多巴胺修饰钛表面纳米载银SEM(a)、XPS(b)、Raman(c)及银离子溶出(d)Fig. 3 SEM (a), XPS (b), Raman spectrum (c) and release of Ag+ (d) of Ti-PDA-Ag |
纳米银颗粒具有表面增强拉曼散射(SERS)特性, 且纳米银粒子的大小、形状等对材料表面SERS影响显著[19]。由拉曼光谱(图3(c))可知, 聚多巴胺修饰钛表面在1300~1600 cm-1出现一个宽峰, 峰强较弱, 来源于聚多巴胺结构中苯环的伸缩振动(1325 cm-1)和变形振动(1590 cm-1)[20]。Ti-PDA-Ag表面1300~1600 cm-1范围内出现较多精细强峰, 且峰强度为Ti-PDA样品峰强度的10倍以上, 说明纳米银负载在Ti-PDA样品表面。聚多巴胺辅助还原得到的纳米银与聚多巴胺中的酚羟基和醌基等存在较强的金属螯合作用, 具有较强结合力[21], 因此本研究不考虑银离子释放过程中纳米银的脱落。图3(d)为Ti-PDA-Ag样品Ag+累积释放量与浸泡时间的关系图, 结果表明, 释放初期(2d), 银离子释放显著, 后趋于稳定; 由原子吸收光谱测定出Ti-PDA-Ag样品在13%的HNO3溶液浸泡16 h后, 其表面的总载银量为(7.1± 0.9) μ g/cm2, 说明释放5 d后溶出的银约占总载银量质量分数的14%, 可以预见, 纳米银修饰的钛表面具有持久的抗菌性能。
已有研究表明, 聚多巴胺结构中存在的苯酚类物质能够抑制有害细菌的繁殖与生长[22], 但其抗菌作用远远达不到常规的抗菌要求。图4为不同样品的杀菌率结果照片, 研究结果表明, 纳米结构化和聚多巴胺修饰钛表面对金黄色葡萄球菌没有明显的抗菌作用, 由公式(1)计算得到的杀菌率分别为2.4%和12.3%; 聚多巴胺/纳米银修饰钛表面具有较强的杀菌作用, 抑菌率达到99.9%。目前普遍认为纳米银之所以具有抗菌作用一方面是因为其释放银离子, 其抗菌机理与银离子类似; 另一方面纳米粒子本身能够引起细胞膜的完整性或渗透屏障的破坏, 导致胞内物质流失, 从而杀灭细菌[23]。纳米银具有长效抗菌作用则源于其释放的银离子在杀灭细菌后, 可以从死亡的细菌体中游离出来, 再与其他菌群接触, 周而复始进行杀菌过程。
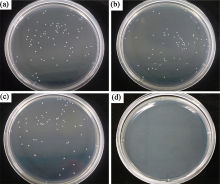 | 图4 Ti(a)、pTi(b)、Ti-PDA(c)和Ti-PDA-Ag(d)样品对金黄色葡萄球菌的抑菌能力照片Fig. 4 Typical photographs of re-cultivated Staphylococcus Aureus colonies on agarTi (a), pTi (b), Ti-PDA (c) and Ti-PDA-Ag (d) |
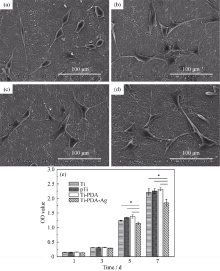
细菌在种植体表面的粘附是种植体周围炎发生发展的起始, 破坏细菌在种植体表面的粘附可以有效地减少细菌在种植体表面的聚集, 从而增加种植体的成功率。电镜结果(图5)显示, Ti、pTi和Ti-PDA样品表面粘附的细菌数量无明显差异, 三者样品表面部分细菌聚集成团, 容易形成生物膜, 细菌在生物膜的保护下, 使抗菌剂难以很好地发挥作用[24]。Ti-PDA-Ag表面细菌粘附数量大大减少, 分布较散, 且部分细菌的细胞发生破裂, 说明纳米银修饰表面具有良好的杀菌和抗细菌粘附作用。
生物材料植入体内后将与组织和细胞直接接触, 因此必须具备良好的生物相容性。图6为钛表面MC3T3-E1细胞的早期粘附和增殖情况。图6(a)显示, 对照样Ti表面MC3T3-E1细胞呈椭球状和长梭形, 并有少量伪足伸展; 而pTi、Ti-PDA和Ti-PDA-Ag表面细胞呈不规则多边形铺展, 细胞伸出较多伪足, 且细胞之间通过伪足相互交联, 证实钛表面纳米结构和聚多巴胺仿生膜层有利于细胞的早期粘附。MTT结果(图6(e))表明, 细胞在材料上培养1 d和3 d, 各组细胞数量无显著性差异; 培养至第5 d和7 d, Ti、pTi和Ti-PDA之间的细胞数量无明显差异, 而Ti-PDA-Ag显示出对MC3T3-E1细胞增殖有一定的抑制作用, 但增殖率仍大于80%, 符合生物材料医用标准, 说明材料均具有良好的体外细胞相容性。
1) 聚多巴胺功能化钛表面通过聚多巴胺与钙离子的螯合作用促进类骨羟基磷灰石沉积, 提高了钛表面的生物活性。
2) 通过聚多巴胺的还原能力成功将纳米银颗粒负载至钛表面, 聚多巴胺/纳米银修饰钛表面对金黄色葡萄球菌具有较强的杀菌能力, 同时体现出较好的细胞相容性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|