作者简介: 段连峰(1981-), 男, 博士, 副教授. E-mail:duanlf@mail.ccut.edu.cn
通过简单溶剂热法合成表面粗糙的立方体结构MnFe2O4颗粒, 样品粒径约为150 nm, 立方体表面球状突起的直径约为10 nm, 该特征增加了样品的比表面积。反应过程中, 通过改变表面活性剂CTAB的加入量, 有效影响晶体各个晶面方向的生长速度, 最终合成不同形貌的样品(立方体、多面体、正八面体结构)。合成样品在室温下都表现出典型的铁磁性质。通过对刚果红和重金属离子CrVI和PbII溶液的吸附实验证明, 表面粗糙的立方体结构MnFe2O4颗粒在污水处理过程中, 可以更高效地去除水中的污染物, 通过磁分离技术回收样品以便再利用, 提高废水净化率。
Manganese ferrite (MnFe2O4) with rough surface was synthesized by a simple solvothermal method. The average diameter of particles was about 150 nm, and the tubes of rough surface about 10 nm. Here, magnetic MnFe2O4 particles with different morphologies (cube, polyhedron and octahedron) were successfully prepared by controlling CTAB concentration. Both of the samples with different morphologies exhibit ferromagnetic behavior at room temperature. The saturation magnetization (
微/纳米晶体颗粒的性质与成分、结构、相组成、形状、大小和粒度分布等密切相关[ 1, 2, 3, 4]。因此, 合成出具有特殊形貌微/纳米材料具有一定的理论意义和较高的实际应用价值。在磁性纳米粒子中, 锰铁氧体是具有高磁渗透性、电导率好和低损耗的尖晶石结构, 被广泛应用于诸多领域。特别是在污水处理的领域, 利用磁分离技术来清洁废水是一种较新的水处理技术。目前, 如何高效深层的去除污水中的重金属离子是急需解决的难题, 已经提出或采用的方法包括化学沉淀、离子交换、吸附、膜过滤、电化学技术和臭氧氧化等等[ 5, 6, 7, 8, 9]。在这些技术中, 吸附方法在设计和操作上都非常灵活, 具有产生高质量的水处理效果。由于吸附过程的可逆性质, 利用磁性纳米颗粒高分离效率的特点, 可以在短时间内检测和分离废水中的有毒成分而有效地减少工作量, 并且许多解吸过程的成本低、效率高, 易于操作[ 10, 11]。
目前可用的纳米金属氧化物吸附剂, 包括纳米铁氧化物、锰氧化物、锌氧化物、钛氧化物, 镁氧化物和氧化铈, 被列为有前途的水系统脱除重金属[ 12, 13, 14]。除了传统的纳米金属氧化物, 磁性氧化物由于具有一定的磁学性能, 在外加磁场的作用下可以从水中分离出来[ 15]。所以, 在污水处理过程中, 吸附剂容易回收和再生[ 16]。磁性纳米颗粒的粒径大小、形态、散布和表面特性对其特性的影响很大, 由于纳米粒子晶体表面具有不同的原子排列和电子结构, 从而使其具有不同性能和磁化能力。因此, 对MnFe2O4微/纳米粒子形貌控制合成的研究具有重要意义。本研究通过简单的溶剂热过程, 控制表面活性剂的加入量, 合成不同形貌的MnFe2O4纳米晶体, 对表面活性剂在合成过程中的作用进行了深入探讨, 并且合成了具有非光滑表面特征的MnFe2O4立方体结构。测试不同形貌样品的磁学参数。此外, 还研究了不同形貌MnFe2O4对于刚果红、重金属离子Pb2+、Cr6+溶液的吸附能力, 进一步扩展了磁性材料的应用领域。
FeSO4·6H2O和乙二醇(北京化工厂) MnSO4·H2O (西陇化工股份有限公司), 十六烷基三甲基溴化铵 (CTAB)和氢氧化钠(国药集团化学试剂有限公司)。样品结构及性能表征: 采用日本理学公司的X射线衍射仪(D/max-2500PC Rigaku, Japan)进行物相分析, 选用铜靶(Cu Kα, λ= 0.154056 nm)为辐射源, 射线管加速电压和发射电流分别为40 kV和200 mA, 扫描速度为4 °/min, 2 θ扫描步长为0.02°。采用JEOL JSM-6700F型场发射扫描电子显微镜(FESEM)进行形貌表征。JEOL 2100F型透射电子显微镜(TEM)、高分辨率透射电镜(HRTEM)观察选区电子衍射花样(SAED)。使用超导量子干涉仪(SQUID)进行磁测量。Agilent Cary 50 UV-Vis分光光度计, 用于刚果红溶液浓度的测定。
1.2.1 MnFe2O4纳米颗粒的合成
实验采用溶剂热法合成MnFe2O4纳米颗粒, 试剂均采用分析纯。将0.278 g FeSO4和0.0845 g MnSO4溶解在20 mL乙二醇中, 其Fe2+和 Mn2+的摩尔比是2:1, 并快速搅拌30 min形成均匀的混合溶液。然后分别添加不同含量(S1: 0 g; S2: 0.5 g; S3: 1 g; S4: 2 g)的十六烷基三甲基溴化铵 (CTAB)和氢氧化钠到溶液中经过30 min的搅拌, 将混合溶液转移到聚四氟乙烯做内衬的不锈钢反应釜中(30 mL容量)密封。在200℃高压蒸汽加热24 h后自然冷却到室温。最后通过离心和洗涤, 在60℃真空烘箱中干燥4 h, 获得试样。
1.2.2 吸附实验
刚果红[ CR, 化学式= C32H22N6Na2O6S2, 分子量= 696.68, λmax= 497 nm]是联苯胺基阴离子偶氮染料, 即两个偶氮基的染料。实验用CR溶液, 在去离子水中加入CR, 配制不同浓度的CR溶液; 分别溶解Pb(NO3)2和K2Cr2O7获得Pb2+和Cr6+(1 g/L)标准溶液。与前期实验方法相同[ 17], 分别在 λmax=497 、283.3和357.9 nm的条件下用紫外可见分光光度计测定不同预定浓度样品的吸光度, 校正CR、Pb2+和Cr6+曲线, 然后将吸附剂添加到上述溶液中, 在达到吸附平衡时, 通过原子吸收光谱法测定MnFe2O4纳米颗粒磁分离后溶液的平衡浓度, 利用质量守恒方程计算吸附总量。
图1(a)是通过溶剂热法在200℃下保温24 h后合成样品S2的MnFe2O4纳米晶体FESEM 照片, 由图可知: 所合成样品为形状规则且表面粗糙的立方体, 样品粒径在100~200 nm之间, 立方体表面球状突起的直径约为10 nm。图1(b)为合成样品的透射电镜照片, 进一步证明合成样品的表面结构特征, 该特征较大幅度增加样品的比表面积。图1(c)为图1(b)中方框区域的高分辨和选区电子衍射照片, 从HRTEM图中测量所得的晶面间距均为0.234 nm, 对应(222)晶面, 而SEAD图中电子衍射斑点相对混乱,说明所合成样品的表面突起的单晶结构并不完整。图1(d)为合成的样品的XRD图谱, 所有衍射峰与标准图谱(JCPDS 10-0319)相符, 证明合成样品为具有面心立方结构特征的MnFe2O4, 并且没有发现其他杂峰存在。
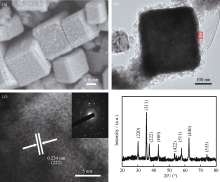 | 图1 样品S2 的低倍扫描电镜照片(a)、透射电镜照片(b)、高分辨率透射电镜照片及其电子衍射图(c)和XRD图谱(d)Fig. 1 FESEM (a), TEM (b), HRTEM images and SEAD pattern (c) and XRD pattern (d) of sample S2 |
为了深入分析溶剂热过程中表面活性剂所起的作用, 通过改变CTAB的量(0、1和2 g)获得了不同形貌的MnFe2O4纳米颗粒。如图2所示, 当不加入CTAB时, 合成出粒径为100~200 nm且表面光滑的立方体。随着CTAB加入量的增大, 颗粒尺寸变化不大, 但形貌发生明显变化。当CTAB加入量分别为1 g 和2 g时, 合成出的样品形貌从多面体变为规整的典型八面体结构。当加入少量CTAB时, 有机官能团与晶粒的表面结合, 使得晶粒表面发生变化导致晶体生长方向不确定, 形成粗糙表面(如图1(a)所示)。随着CTAB加入量的增大, 大量有机官能团吸附在(111)晶面[ 18, 19], 抑制晶体沿着该晶面方向的生长速度, 以致于其他方向速度远大于该晶面方向的生长速度[ 20], 随着晶粒的进一步生长, 其他晶面逐渐消失, 最终形成多面体和八面体的形貌特征。图3为溶剂热法合成的MnFe2O4颗粒(立方体、多面体、正八面体)的XRD图谱, 如图所示, 合成的不同形貌样品的所有衍射峰均与标准衍射峰相一致, 也没有发现存在其他杂峰。
为了研究MnFe2O4的形貌对其磁学性质的影响, 通过超导量子干涉仪(SQUID)测定不同样品磁学参数, 图4是其在室温下测试的磁滞回线。由图4可知, 所合成样品均具有典型软磁材料的性能, 具体的磁学参数从图4及表1可以看到, 样品S2、S3、S4的饱和磁化强度( Ms)和剩磁( Mr)分别为58.7、76.7、61.3 Am2/kg和6.23、0.95、6.87 Am2/kg。说明所合成样品均具有亚铁磁性, 且样品的饱和磁化强度相差不大, 较高。而正八面体(S4)的矫顽力( Hc)为6.87 kA/m, 比其他粒子(6.23和0.95 kA/m)高得多。Néel的早期研究和最近的理论研究都说明矫顽力随着表面各向异性程度的减少而减少[ 21, 22]。八面体的形状各向异性最大, 所以其矫顽力也最大。另外, 具有非光滑表面结构的立方体由于表面的结晶程度较差, 所以其饱和磁化强度相对较小。由此可知, MnFe2O4的形貌对其磁学性质有较大的影响。正是因为所合成的样品具有典型软磁性能, 可以随外加磁场的作用而发生运动和团聚, 易于通过磁分离技术在废水处理中重新回收和再利用。
 | 图4 在室温下测得不同形貌样品的磁滞回线表1 不同样品磁学参数Fig. 4 Hysteresis loops of the magnetite with special morphologies tested at room temperature |
| 表1 不同样品磁学参数 Table 1 Magnetism parameters of different samples |
工业生产中排出的污水中包含大量有机污染物和多种重金属离子, 而大部分的有机污染物是以水溶性钠盐的形式存在。由于其稳定的化学结构, 不与光、水和许多化学物质发生分解反应, 因此, 染料一旦被释放到水体环境中, 就极难被清除, 必须在放入接收流之前进行吸附[ 23]。同时, 污水中的重金属离子与人和动物血浆中的血清蛋白相互作用[ 24], 会影响生物体的葡萄糖、脂肪、蛋白质的新陈代谢。因此, 提高吸附剂的吸附效果是除去污水中有机污染物和多种重金属离子的有效途径之一。目前常用的吸附剂有活性炭、天然的有机和无机吸附剂以及合成吸附剂。麦麸、米糠、粘土和高岭土对CR溶液的吸附量大约为10~40 mg/g, 对重金属离子Cr6+的吸附约为10~30 mg/g, 对Pb2+的吸附约为20~60 mg/g[ 25, 26, 27, 28]。实验制备的MnFe2O4铁氧体纳米粒子具有粗糙表面特征, 有利于吸附各种有机溶剂, 从而有助于解决污水处理的难题。另外, 粒子在外加磁场作用下具有较强的铁磁性, 可通过简单的磁分离过程重复使用。
图5(a)为样品对CR溶液的吸附能力曲线, 由图可知样品S2、S3、S4其对CR的吸附值分别为92.4、70.3、66.8 mg/g。随着比表面积的增加, MnFe2O4对CR的吸附能力也随之增加。当比表面积达到59.69 m2/g (样品S1)时, MnFe2O4对CR的吸附能力达到最大值92.4 mg/g。此外, 在吸附实验开始的5 min内, CR的吸附速度最快, 这有效地提高了短时间污水处理的效率。吸附60 min后, MnFe2O4对CR的吸附能力几乎达到饱和。为了了解染料初始浓度和接触时间对吸附CR的影响, 选择三个不同浓度(30、50和100 mg/L )的CR溶液, 研究污染物浓度对样品S2吸附能力的影响。如图5(b)所示, 随着CR初始浓度从30 mg / L增大到100 mg/L, 样品吸附CR的量从66.8上升到 92.4 mg/g。
同样, 将合成的MnFe2O4纳米粒子应用到含有重金属的污水处理中, 图5(c)和(e)分别是MnFe2O4对含Cr6+、Pb2+溶液的吸附能力曲线, 由图可知样品S2、S3、S4对Cr6+的吸附值分别为54.4、40.8、38.9 mg/g, 对Pb2+的吸附值分别为84.4、66.3、55.6 mg/g。同样随着比表面积的增加, 纳米微粒对Cr6+、Pb2+的吸附能力也增加。如图5(d)和(f)所示, 选择三个不同浓度(30、50、100 mg/L)的Cr6+和Pb2+溶液, 研究污染物浓度对样品S2吸附能力的影响, 样品S2对Cr6+的吸附量分别为33、43.8和54.4 mg/g, 对Pb2+的吸附量分别为48.3、66.6和84.4 mg/g。在吸附开始的5~10 min内, 吸附迅速, 随着搅拌时间延长到20~30 min, 吸附效果取决于染料初始浓度, 延长搅拌时间仍可保持微弱增长, 整个吸附过程大约在40 min之内完成。由此可知, 通过简单溶剂热法合成具有粗糙表面特征的MnFe2O4颗粒, 对于有机污染物干果红和重金属离子Cr6+和Pb2+具有较强的吸附能力, 在污水处理领域有着应用前景。
通过溶剂热法合成了表面粗糙的MnFe2O4立方体纳米颗粒。改变表面活性剂CTAB的加入量合成不同形貌的纳米晶体, 包括: 立方体、多面体、正八面体结构。合成样品在室温下都表现出典型的铁磁性。通过不同形貌纳米颗粒对刚果红和重金属离子Cr6+、Pb2+溶液的吸附实验发现, 具有粗糙表面特征MnFe2O4纳米颗粒表现出较高的吸附能力。因此, MnFe2O4纳米颗粒是对于含有机污染物和重金属离子的污水处理具有良好效果的新型吸附材料。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|





