通讯作者: 李锐星, 教授. E-mail:ruixingli@yahoo.com
作者简介: 杨碧云(1989-), 女, 硕士研究生. E-mail:yangbiyun08@163.com
以正丙醇锆、硼酸、醋酸和D-果糖为原料, 采用溶胶-凝胶法, 结合高温碳热还原反应制备得到了长柱状单相ZrB2粉末。反应体系中, D-果糖不仅提供碳热还原反应的碳源, 同时作为化学修饰剂, 起到抑制正丙醇锆快速水解的作用。通过对比未陈化和陈化的凝胶制备得到的产物, 探讨了陈化过程对于ZrB2粉末制备的影响。结果表明, 凝胶陈化有利于ZrO2向ZrB2的完全转化。当起始原料满足
ZrB2 particles were synthesized by a Sol-Gel method using zirconium n-propoxide, boric acid, acetic acid and D-fructose. D-Fructose acts as both a modifier and a carbon source for carbothermal reduction reaction. For comparison, both nascent state gel and aged gel were used to clarify the aging-time-dependent mechanism for ZrB2 synthesis. As a result, a single phase ZrB2 powder with a uniform size and shape distribution can be obtained from the aged gel with a boron and carbon to zirconium molar ratio of 3.5-4 and 7, respectively, after reduced at 1550 ℃ for 2 h. Besides, the synthesized ZrB2 particles exhibit prism-like morphology with average particle size of
ZrB2陶瓷具有高熔点(3250 ℃)、高硬度(22 GPa)、高热导率和电导率以及优异的抗热震性能, 是很有前景的超高温材料, 有望在火箭发动机和超高音速飞机等领域得到应用[ 1, 2, 3]。
合成ZrB2陶瓷粉末的方法有很多, 如固相反应法[ 4]、水热法[ 5]、机械合金化法[ 6]以及高温自蔓延法[ 7]等。然而, 由于上述方法所需的温度较高或者条件较为苛刻, 合成出的粉末在颗粒尺寸、纯度等方面往往不能满足科研或者生产的需要。与之相比, 溶胶-凝胶法在制备过程中可生成无定形的亚稳相, 反应物在分子水平均匀混合, 是一种有效的低温合成陶瓷粉末的方法。迄今, 许多课题组采用溶胶-凝胶法成功制备得到了不同种类的陶瓷粉末, 如TiB2[ 8]、ZrC[ 9]、SiC[ 10]等。但是, 有关溶胶-凝胶法合成ZrB2粉末的报道还很少。Xie[ 11]和Yan[ 12]等分别选用正丙醇锆和氧氯化锆作为锆源, 酚醛树脂和硼酸作为碳源和硼源, 通过溶胶-凝胶法制备得到球形ZrB2颗粒。此外, 李运涛等[ 13]采用自制的聚乙酰丙酮锆作为锆源, 酚醛树脂和硼酸作为碳源和硼源, 通过液相前驱体转化法也制备得到ZrB2颗粒。本课题组前期也采用不同的方法制备得到了不同形貌(等轴状、球形、链状、板状)的ZrB2颗粒[ 14, 15, 16]。
本研究采用小分子有机物D-果糖(左旋糖)作为碳源, 通过溶胶-凝胶法制备颗粒形貌为长柱状的ZrB2粉末。
正丙醇锆(Zr(OPr)4)(70wt%正丙醇溶液, 上海晶纯试剂有限公司); 硼酸(H3BO3)、D-果糖(C6H12O6)、醋酸(AcOH)和乙醇(C2H5OH)(分析纯, 北京化工厂)。
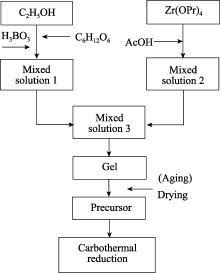
ZrB2粉末的制备工艺流程图如图1所示。将一定量的H3BO3(3.0 g)和C6H12O6(1.8 g)加入到连续搅拌的C2H5OH(20 mL)中, 并在60 ℃保温条件下搅拌10 min, 得到无色澄清混合溶液1。将Zr(OPr)4(6.0 mL)滴加到AcOH(10.0 mL)中, 得到混合溶液2。在磁力搅拌条件下, 将溶液2缓慢加入到溶液1中, 得到黄色胶体。将所得湿凝胶一部分直接转移到干燥箱中80 ℃干燥6 h, 另一部分则在室温陈化7 d后再进行干燥, 干燥后再经研磨即可得到前驱体粉末。然后, 将所得前驱体粉末置于氧化铝管式炉中, 氩气保护气氛下分别在1300和1550 ℃保温2 h, 得到最终粉末。
利用X射线衍射(XRD, Rigaku, D/MAX 2200 PC)分析粉体的物相组成; 通过扫描电镜(SEM, Hitachi S-4800, Tokyo, Japan)表征粉体的形貌; 采用激光粒度分析仪(LS Particle Size Analyzer, Beckman Coulter LS 13 320, America)分析粉体的粒度分布; 通过全自动比表面积和孔径分析仪(Automated Surface Area & Pore Size Analyzer, QUADRASORB SI- MP, Quantachrome, America)测定粉体的比表面积。
在溶胶-凝胶过程中, 金属无机盐或金属醇盐与适量的水混合后, 发生水解-缩聚反应形成均匀的溶胶, 干燥脱水后转化为凝胶。但是, 金属醇盐遇水后往往迅速水解并易生成沉淀。为了抑制金属醇盐的快速水解, 避免沉淀的生成, 常常需要加入合适的络合剂。AcOH是一种有效的络合剂, 能够抑制金属醇盐的快速水解[ 16, 17, 18]。根据文献[18], 实验选用AcOH络合Zr(OPr)4, Zr(OPr)4中的OPr基团被AcOH的OAc基团取代后, 会生成一种新的螯合物Zr(OAc)2(OPr)2[ 18]。而这种螯合物又可以进一步与果糖发生酯交换反应[ 18], 生成一种多羟基化合物。值得一提的是, 该体系里没有加水, 但是未反应的AcOH与溶剂C2H5OH发生酯化反应生成水, 从而有效地控制着Zr(OAc)2(OPr)2的一系列水解反应。
Zr(OPr)4 + 2AcOH → Zr(OAc)2(OPr)2 + 2PrOH (1)
PrO-Zr(OAc)2(OPr) + HO-X-OH → PrO-Zr(OAc)2- O-X-OH + PrOH (2)
其中, X代表C6H10O4。
AcOH + C2H5OH → C2H5OAc + H2O (3)
Zr(OAc)2(OPr)2和PrO-Zr(OAc)2-O-X-OH经过水解缩聚反应, 形成由Zr-O-Zr和Zr-O-X-O- Zr连接起来的三维网状结构。当所有反应完成之后, 即可得到黄色的胶体。再经干燥、研磨便可得到前驱体粉末。
该体系生成ZrB2的碳热还原反应方程式如下:
ZrO2 + B2O3 + 5C → ZrB2 + 5CO (4)
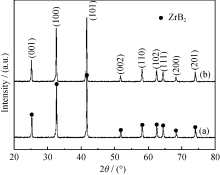
根据反应式(4), B与Zr的摩尔化学计量比应该为2, 即 n(B)/ n(Zr) = 2, 但实验选用 n(B)/ n(Zr) = 3.5和4, 这是因为B2O3的低熔点和高蒸汽压的特性致使其在高温下会有所损失, 因此需适当提高硼酸的添加量。采用未陈化凝胶制得的一组不同原料配比的试样在1550 ℃保温2 h后的XRD图谱如图2所示。假设D-果糖中的碳完全分解成单质碳参与反应(4), 基于该反应的化学计量比 n(C)/ n(Zr)= 5, 但实验结果显示, 除了ZrB2以外仍残留单斜氧化锆(m-ZrO2)和四方氧化锆(t-ZrO2)(图2a)。这说明D-果糖中的碳并没有全部转化为单质碳参与碳热还原反应(4), 因此还需适当提高D-果糖的添加量以提供充足的碳。当 n(C)/ n(Zr)增加到7时, 如图2(b)所示, t-ZrO2仍然存在。此时, 即使继续提高 n(B)/ n(Zr)到4, 仍然无法全部消除t-ZrO2(见图2c)。
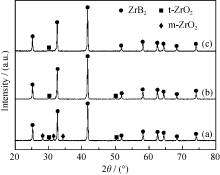 | 图2 采用未陈化凝胶制备的试样在1550 ℃保温2 h后的XRD图谱Fig. 2 XRD patterns of ZrB2 powders calcined at 1550 ℃ for 2 h using nascent state gels |
根据上述结果, 将 n(C)/ n(Zr) 进一步提高到8, 制备的 n(B)/ n(Zr) = 3.5和4两个试样的物相分析结果如图3所示。从图3可以看出, 此时不仅有残留的t-ZrO2, 而且出现了ZrC。生成ZrC的反应方程式如下:
ZrO2 + 3C → ZrC + 2CO (5)
生成的原因是D-果糖的添加量过高导致局部碳过量引发了反应(5)。综上所述, 使用未陈化的凝胶在1550 ℃保温2 h的条件下反应(4)不能进行完全, 也就无法得到单相ZrB2。
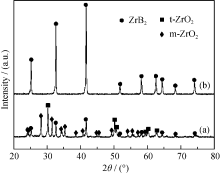
鉴于此, 需要对凝胶进行陈化处理, 同样制备了 n(B)/ n(Zr) = 3.5、4, n(C)/ n(Zr) = 7的试样。图4给出了这两个试样在1550 ℃保温2 h后的XRD图谱。从图4可以看出, 当 n(C)/ n(Zr) = 7, n(B)/ n(Zr) = 3.5和4均获得了单相ZrB2, 不再有残留的t-ZrO2。对比图2(b)、(c)和图4(a)、(b), 可以发现: 采用陈化凝胶在1550 ℃保温2 h的条件下反应(4)可以进行完全。凝胶的陈化过程包含接枝、交联、脱水缩合、相变和结晶等过程, 这些转变会影响其物理或化学性质。对于该反应体系, 陈化过程提高了整个体系的反应活性, 有助于反应的完成。
最后, 实验尝试使用陈化凝胶在较低温度, 即1300 ℃下进行碳热还原的可能性。从图5可以看出, 1300 ℃煅烧后所制得样品中ZrB2的衍射峰与1550 ℃相比较弱, 而且存在m-ZrO2和t-ZrO2相。说明碳热还原反应(4)在1300 ℃已经发生, 但进行得不完全。
起始原料以及合成工艺决定了粉末的最终形貌。图6给出了起始原料 n(B)/ n(Zr)= 3.5, n(C)/ n(Zr)= 7, 采用陈化凝胶在1550 ℃保温2 h得到的ZrB2粉末形貌。从图6可以看出, ZrB2粉末颗粒呈长柱状, 长度为4 ~ 7 μm, 横截面等效直径约为1 μm, 长径比约为4 ~ 7, 尺寸分布比较均匀。粉体有一定的团聚, 形成较大的团聚颗粒。
 | 图6 n(B)/ n(Zr)= 3.5, n(C)/ n(Zr)= 7采用陈化凝胶在1550 ℃保温2 h制备的ZrB2粉末的SEM照片Fig. 6 SEM image of ZrB2 powders calcined at 1550 ℃ for 2 h using the aged gel with molar ratios of B/Zr = 3.5 and C/Zr = 7 |
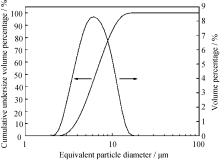
图7为起始原料 n(B)/ n(Zr) = 3.5, n(C)/ n(Zr) = 7, 采用陈化凝胶在1550 ℃保温2 h制备的ZrB2粉末的粒度分布图。从图7可以看出, ZrB2粉末的颗粒尺寸分布呈正态分布, 颗粒尺寸比较集中, 中位径 D50为6.46 μm, 这与图6的SEM结果一致。
使用液氮进行比表面积测试, 所得结果如表1所示。结果表明, 使用未陈化凝胶得到的ZrB2粉体的比表面积为15.29 m2/g, 而使用陈化凝胶的比表面积为2.53 m2/g。这可能与陈化过程提高了反应活性, 结晶化学过程更加完全有关。
| 表1 起始原料 n(B)/ n(Zr) = 3.5, n(C)/ n(Zr) = 7, 采用未陈化和陈化凝胶在1550 ℃保温2 h得到的ZrB2粉末的比表面积(BET) Table1 Specific surface areas (BET) of ZrB2 powders calcined at 1550 ℃for 2 h using nascent state gels and aged gels with molar ratios of B/Zr = 3.5 and C/Zr = 7 |
在溶胶-凝胶法制备ZrB2粉体过程中, 凝胶陈化有利于ZrO2向ZrB2的完全转化。以正丙醇锆、硼酸、醋酸和D-果糖为原料, 采用溶胶-凝胶法, 当起始原料 n(B)/ n(Zr)= 3.5 ~ 4, n(C)/ n(Zr) = 7时, 采用室温陈化7 d的凝胶, 在1550 ℃保温2 h后可获得颗粒形貌为长柱状, 长度为4 ~ 7 μm, 横截面等效直径约为1 μm, 长径比约为4 ~ 7, 比表面积为2.53 m2/g, D50 = 6.46 μm的单相ZrB2粉末。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|