张玉晖(1987-), 女, 硕士研究生. E-mail:zhangyuhui110@126.com
在Fe3+或Co2+存在下进行吡咯的聚合反应, 得到金属离子掺杂的聚吡咯, 并在N2气氛下700℃碳化, 再将该碳化产物在900℃焙烧得到含有不同金属的复合催化剂PPY-M(M为不同的金属)。采用SEM、XRD等对催化剂的结构进行了表征。通过循环伏安和线性电位扫描等电化学手段, 研究了催化剂对氧还原(ORR)的电催化活性及其稳定性。结果表明, 掺杂金属钴的催化剂的活性最好, 在酸性溶液中ORR的起始电位达到0.54 V(
Polymerization reaction of pyrrole in the presence of Fe3+ and Co2+ was carried out to synthesize the metal -doped polypyrrole (PPy). The metal-doped PPy was then calcined at 700℃ to obtain the carbonized products. Finally, the carbonized products were heated to 900℃ to synthesize the catalysts PPY-M(M is Fe or Co). The structure of the catalysts was investigated by SEM and X-ray diffraction techniques. The oxygen reduction reaction (ORR) activities of the catalysts in acidic and alkaline media were tested by voltammetry. Results show that the catalyst PPY-Co presents the highest electrocatalytic activity for ORR. The ORR current density at rotation rate of 2000 r/min is 7.5 mA/mg@-0.3 V(
燃料电池是一种将化学能转化为电能的“绿色能源技术”, 具有效率高、污染小、启动快等优点[ 1]。其中, 使用质子交换膜的醇燃料电池(PEMAFC)受到人们广泛关注, 其阴极过程是氧气还原反应(ORR), 而Pt以及Pt基金属催化剂是目前最好的ORR催化剂, 但Pt资源匮乏、价格昂贵[ 2, 3, 4], 另外由于醇分子(如甲醇)能够穿过质子交换膜进入到阴极, 在Pt基催化剂发生氧化, 使阴极的ORR活性降低, 且甲醇在阴极上的反应也会使阴极电催化剂中毒[ 5], 致使电池性能急剧下降和电池使用寿命短。
1964年Jasinsk[ 6]首次研究了含氮金属大环化合物对ORR的电活性。这种氮掺杂碳材料负载过渡金属材料对氧还原反应具有高活性和高选择性, 且对甲醇氧化呈惰性, 近来成为研究热点, 引起人们极大兴趣[ 7]。通过对过渡金属大环化合物高温加热, 提高了其在酸性环境中的稳定性, 但不改变其催化活性[ 8, 9]。聚吡咯是一种新型的导电聚合物, 具有稳定性好、导电率高、适用范围广、易于合成等诸多优点[ 10, 11, 12], 近年来受到人们关注。Yuasa等[ 13]在炭黑上包覆聚吡咯再负载金属, 制备出催化剂Co/PPy/C; Bashyam等[ 14]在炭黑载体上以化学聚合法得到PPy-C复合载体, 再在其表面上还原硝酸钴得到阴极催化剂, 但催化剂的制备过程较复杂, 电流密度较小。本工作采用在吡咯单体聚合的过程中加入金属离子, 再通过高温热处理制备出燃料电池阴极催化剂, 采用物理以及电化学手段对催化剂进行表征和测试。
氢氧化钠、浓硫酸、浓盐酸(36wt%~38wt%)、FeCl3·6H2O、Co(NO3)2·6H2O、吡咯单体、无水乙醇、过硫酸铵均为分析纯; Nafion溶液(5wt%); 水为二次蒸馏水。ATA-IB旋转圆盘电极(江苏电分析仪器厂)、管式炉(天津中环实验电炉有限公司)、CS300腐蚀电化学测试系统(华中科技大学)、JSM26380LV扫描电子显微镜(日本JEOL)、XRD衍射仪(Ultima IV Multipurpose X-Ray Diffraction System)、原子吸收仪(AAnalyst300 美国PerkinElmer公司)。
1.2.1 催化剂的制备
(1) PPY: 取360 μL吡咯单体溶解于30 mL水中(溶液A); 将1.14 g(NH4)2S2O8溶解于10 mL水中(溶液B)。将溶液A和B混合均匀, 在20℃反应24 h。过滤, 真空干燥得到样品前驱体。将置于石英坩埚中的样品放在管式炉中, 先用N2将管式炉中的空气
排尽, 使其充满N2后以2 ℃/min速率从室温升至350℃并恒温2 h, 然后以相同升温速率继续升温到700℃并恒温2 h, 使聚吡咯完全炭化。样品自然冷却至室温后, 用80℃的0.5 mol/LH2SO4加热8 h以除去不稳定物质, 过滤, 真空干燥。将干燥后的样品在充满N2的管式炉中以4 ℃/min的升温速率从室温升至900℃, 之后冷却, 直至炉温降至室温后停止通N2, 取出样品, 即得催化剂PPY。
(2) PPY-Fe: 制备过程与PPY相同, 但溶液B的制备为: 将1.14 g(NH4)2S2O8与0.13 g FeCl3·6H2O溶解于10 mL水中。
(3) PPY-Co: 制备过程与PPY相同, 但溶液B的制备为: 将1.14 g(NH4)2S2O8与0.15 g Co(NO3)2· 6H2O溶解于10 mL水中。
(4) PPY-Fe-Co: 制备过程与PPY相同, 但溶液B的制备为: 将1.14 g(NH4)2S2O8、0.065 g FeCl3· 6H2O与0.075 g Co(NO3)2·6H2O溶解于10 mL水中。
1.2.2 催化剂的表征
催化剂中负载的金属元素质量分数用原子吸收光谱测试, 结果如表1所示。
以1.92 mL乙醇作溶剂, 加入10 mg上述制备的催化剂样品和0.08 mL Nafion溶液, 超声1 h形成均匀墨水状。将玻碳电极(直径为4 mm)用刚玉抛光, 用二次蒸馏水冲洗干净后晾干, 取15 μL催化剂墨水均匀涂在玻碳电极上, 自然晾干, 即为工作电极。
电化学测试在传统的三电极体系中进行, 其中辅助电极为铂电极, 参比电极为饱和甘汞电极, 工作电极用旋转圆盘电极, 电解质溶液为1 mol/L NaOH溶液或0.5 mol/L H2SO4溶液。循环伏安行为测试前, 用高纯氮和高纯氧通入电解质溶液中15 min, 分别得到N2饱和与O2饱和的电解质溶液, 电位扫描速度均为20 mV/s。极化曲线测量的扫描速率均为5 mV/s, 旋转圆盘电极的转速为0~2000 r/min。测试均在室温(20±2)℃下进行。
图1为催化剂的SEM照片, 从图中看出, 所制备出的催化剂为类似球状的聚吡咯纳米颗粒, 颗粒之间相互连接, 形成了一种网状的多孔结构。从图1(a)、(d)看出, PPY和PPY-Fe-Co催化剂的颗粒较小, (a) PPY; (b) PPY-Fe; (c) PPY-Co; (d) PPY-Fe-Co 粒径约为200~300 nm; 而PPY-Fe和PPY-Co的颗粒(见图1(b)、(c))相对较大, 粒径约为400~500 nm。从图1还可以看出, 各催化剂的粒径分布比较均匀, 而且这种多孔结构使催化剂的实际表面积大大增加, 从而增加它们对氧还原反应的电催化活性。
| 表1 不同催化剂中负载金属元素的质量分数 Table1 Mass percentage of metal in catalyst |
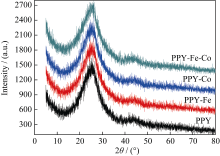
图2为催化剂的XRD图谱, 在24.2°(002)和43.2°(101)处出现2个不同的衍射峰为CN X的特征峰, 含有不同金属催化剂的XRD图谱基本相同。图中没有出现很明显的金属或金属氮化物的峰, 是由于催化剂中的金属负载量较小[ 15], 这与文献[15]的结果基本一致。
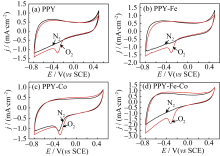
图3为催化剂在0.5 mol/LH2SO4溶液中的循环伏安图, 从图中看出, 四种催化剂在饱和O2中的阴极电流较饱和, N2的阴极电流都有增加, 并且PPY、PPY-Fe、PPY-Co(图3a、b、c)在0 V左右都出现了对氧的还原峰, 而PPY-Fe-Co并没有出现很明显的还原峰, 这是由于催化剂在酸性溶液中对ORR的动力学改善不明显, 氧还原反应开始后, 溶液中O2能够及时补充到电极表面, 电流密度增加缓慢, 因此没有产生很明显的还原峰。
图4为催化剂在1 mol/L NaOH溶液中的循环伏安图, 从图中看出,催化剂PPY-Fe-Co在O2饱和的溶液中(图4d), 其循环伏安曲线的阴极电流密度明显高于在N2饱和的溶液中(图4d); 且图4显示, 所有催化剂均在-0.3 V处出现了明显的还原峰, 这说明催化剂在碱性电解质中对氧还原同样具有较强的催化活性。
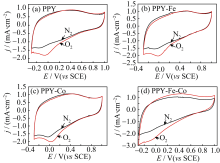 | 图3 催化剂在N2饱和和O2饱和的0.5 mol/L H2SO4溶液中的循环伏安图, 扫描速率为20 mV/sFig. 3 Current-potential curves in N2-saturated and O2-satu rated 0.5 mol/L H2SO4. Scan rate at 20 mV/s |
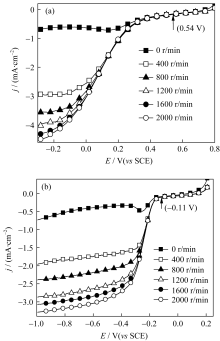
图5为催化剂在O2饱和0.5 mol/L H2SO4溶液中的极化曲线图。从图5可以看出, 不含金属的催化剂PPY对氧还原的活性最小, 氧还原起始电位约为0.43 V( vs SCE)(图5中箭头所示), 氧还原电流密度最低; 加入金属后的催化剂性能有了明显改善, 尤其是加入钴的催化剂, 对氧还原的活性明显增大, 其氧还原的起始电位正移, 达到0.54 V( vs SCE)(图5中箭头所示),同时氧还原的极限电流密度也达到4.5 mA/cm2@-0.3 V( vs SCE)。
图6为不同的催化剂在1 mol/L NaOH溶液中, 对氧还原反应的极化曲线图, 从图中看出, 不含金属的催化剂PPY对氧还原的活性最差, 它的氧还原起始电位以及极限电流密度均最小; 与之相反, 加入金属钴的催化剂PPY-Co对氧还原反应的活性最好, 其初始电位为-0.11 V( vs SCE)(图6中箭头所示),极限电流密度达到3.3 mA/cm2@-0.9 V( vs SCE)。
进一步研究催化剂PPY-Co在酸性和碱性溶液中, 不同电极转速下的极化曲线。从图7(a)看出, 在0.5 mol/L H2SO4溶液中, 随着转速的增大电流密度也随之增加, 在电位小于0.54 V( vs SCE)(图7a中箭头所示)时, 电流密度急剧增加, 这一区间为氧还原的活性电位区间, 表明催化剂对氧还原具有优异的催化活性。在电位低于-0.15 V( vs SCE)时, 氧还原电流趋于平稳, 表明在此区间氧还原反应受氧气扩散控制。在1 mol/L NaOH溶液中(图7(b)), 氧还原反应的起始电位为-0.11 V( vs SCE)(图7(b)中箭头所示), 氧还原反应的活性电位区间为-0.11~-0.3 V, 电位低于-0.3 V之后呈现出明显的电流平台。进一步从图7(a)看出, 在2000 r/min时电流密度达到 4.5 mA/cm2@-0.3 V( vs SCE), 如果考虑催化剂的质量, 则电流达到7.5 mA/mg@-0.3 V( vs SCE); 同样在碱性溶液中, 2000 r/min时的氧还原电流也达到 5.7 mA/mg@-0.8 V( vs SCE)。
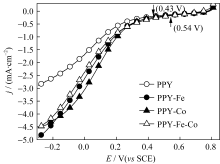 | 图5 催化剂在O2饱和的0.5 mol/LH2SO4溶液中的极化曲线图, 转速: 2000 r/min, 扫描速率: 5 mV/sFig. 5 RDE polarization curves of the samples in O2-saturated 0.5 mol/L H2SO4 at 2000 r/min and scan rate at 5 mV/s |
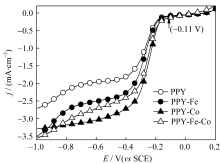 | 图6 催化剂在O2饱和的1 mol/L NaOH溶液中的极化曲线图。转速: 2000 r/min, 扫描速率: 5 mV/sFig. 6 RDE polarization curves of the samples in O2-saturated 1mol/L NaOH at 2000 r/min and scan rate at 5 mV/s |
图8为不同催化剂的Koutecky-Levich曲线, 由相应的K-L方程:
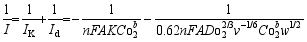
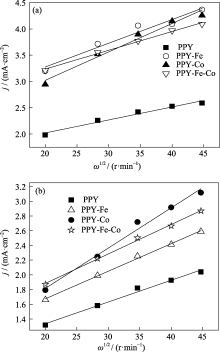 | 图8 不同催化剂在0.5 mol/L H2SO4(a)和1 mol/L NaOH(b)中的氧还原反应Koutecky-Levich图Fig.8 Levich plots of various catalysts in 0.5 mol/L H2SO4 (a) and 1 mol/L NaOH (b) |
可以计算出氧还原过程中氧气转移的电子数[ 16], 式中 I为电流, IK为动力学电流密度, Id为极限扩散电流密度, n为每分子氧气转移的电子数, K为氧还原的速率常数, F为法拉第常数, A为电极面积, ω为旋转速率, Co2b为O2在0.5 mol/L H2SO4中的饱和浓度(1.18×10-3mol/L), 或在1 mol/L NaOH中的饱和浓度(0.84×10-3mol/L)[ 17]; Do2为氧气在0.5 mol/L H2SO4的扩散系数(1.95×10-5cm2/s), 或在1 mol/L NaOH中的扩散系数(1.65×10-5cm2/s)[ 17]; ν为 0.5 mol/L H2SO4溶液的运动粘度(1.009×10-2cm2/s), 或1 mol/L NaOH溶液的运动粘度(1.1×10-2cm2/s)[ 18]。计算得到催化剂的电子转移数见表2。
从表2看出, 不同催化剂的氧还原反应电子数相差很大, 在酸性溶液中, 催化剂PPY的电子转移数最少, 催化剂PPY-Co的转移电子数为3.4, 接近4, 表明在PPY-Co上氧还原过程主要以四电子反应历程进行[ 19]。同样在碱性溶液中, 氧气在PPY-Co上的还原也接近四电子过程。结果表明无论在酸性还是碱性溶液中, PPY-Co可以较彻底地催化氧还原, 作为燃料电池的阴极材料具有重要应用价值。
| 表2 不同催化剂上氧还原的电子转移数 Table 2 Electron-transfer number of ORR on various catalysts |
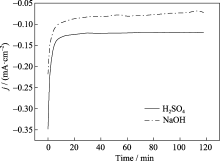
采用计时电流法进一步研究了催化剂的稳定性, 如图9所示, 在电解开始阶段, 电流密度较大, 在前10 min内电流密度迅速减小, 之后电流密度保持稳定。在酸性溶液中, 其稳定电流密度约为0.14 mA/cm2, 经过2 h的测试, 电流密度基本不变。在NaOH溶液中, 氧还原反应的稳态电流密度小于酸性溶液中, 但其值同样保持相对稳定。结果说明催化剂无论在酸性或碱性电解液中, 对氧还原反应都有较稳定的电催化活性。
将聚吡咯或将掺杂金属的聚吡咯进行直接炭化, 制备出对氧还原反应具有较强电催化活性的新型催化剂。催化剂颗粒的平均粒径大致相同, 分布比较均匀, 且颗粒之间形成了多孔的网状结构, 有利于其催化活性的提高。循环伏安以及线性扫描研究结果表明, 掺杂金属钴的催化剂PPY-Co的活性明显高于其他催化剂, 在酸性溶液中, 氧还原起始电位达到0.54 V( vs SCE), 电流密度为7.5 mA/mg@-0.3 V ( vs SCE); 在碱性溶液中的起始电位为-0.11 V( vs SCE), 电流密度为5.7 mA/mg@-0.8 V ( vs SCE)。无论在酸性或是碱性溶液中, 氧还原过程均近似以四电子反应进行。恒电位阶跃曲线表明, 催化剂对氧还原反应具有优异的电催化稳定性。PPY-Co可以较彻底地催化氧还原, 作为燃料电池的阴极材料具有重要应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|