王 哲(1987-), 男, 博士研究生. E-mail:fuzzywong@foxmail.com
利用超声探针在铝合金圆片上雕刻微米沟槽图案作为模板, 并成功地将此沟槽图案转移到羟基磷灰石(HAP)陶瓷表面上。扫描电子显微镜(SEM)表征结果显示3种沟槽宽度分别为20、40和60 μm, 与预先设计沟槽的尺寸一致; 接触角测量结果表明, 沟槽化HAP表面的纯水润湿性随沟槽宽度的减小而明显提高。对体外培养在三种沟槽尺寸HAP表面成骨细胞(MC3T3-E1)的形态观察、细胞核染色计数以及细胞取向角测量统计分析的结果表明, 沟槽化的HAP表面具有引导成骨细胞沿沟槽方向铺展的作用, 而且这种引导作用随着沟槽变窄而显著增强, 但这种引导作用并没有对成骨细胞的早期(30 h)增殖行为产生影响。
Hydroxyapatite (HAP) ceramic with orderly micro-patterned surface were fabricated by transferring micro-groove patterns from an aluminum alloy template, which was carved by an ultrasound-driven microprobe. The surface morphologies, phase compositions, and water wettability of samples were respectively analyzed with scanning electron microscope (SEM), X-ray diffraction (XRD), and contact angle measurements. The groove widths of three-kind samples were about 20, 40 and 60 μm, in lined with the designed values. Water wettability of the grooved HAP surfaces was found to be significantly increased by decreasing groove-width. Furthermore, the influences of the grooved HAP surfaces on the behavior of osteoblasts (MC3T3-E1) were examined by measuring cell orientation and counting the cell number. The results showed that the cells were oriented along the groove direction, and the cell orientation angles decreased with a decrease in groove-width, whereas no significant difference in the number of osteoblasts was observed. In summary, the groove-width of micro-patterned HAP has a distinct effect on the directed growth of osteoblast cells.
羟基磷灰石陶瓷(hydroxyapatite, HAP)因特有的化学组成和良好的生物活性及骨传导性已成为硬组织修复材料的首选材料之一[ 1, 2, 3]。HAP植入体内后, 可成为细胞外微环境的一个组成部分, 其化学组成、力学特性和微观几何结构都将对细胞行为产生重要影响。迄今, 人们就HAP的化学、力学和三维多孔结构对骨组织的影响已有相当广泛和深入的研究。其中, 大量的研究都集中在筛选适合骨组织生长的HAP多孔结构(孔尺寸, 孔隙率和孔的贯通性)上[ 4, 5, 6]。从空间尺度效应的角度看, 在微尺度(10~100 μm)下, 多种细胞的粘附、铺展、迁移、增殖、分化甚至凋亡等行为, 除了受细胞外微环境的生化性质影响外, 还与细胞接触到的固体/半固体材料表面的几何结构的尺寸和形状有关。例如, 大多数细胞在微沟槽阵列固体表面都表现出沿沟槽方向拉伸铺展的特性, 产生接触引导(contact guidance)[ 7, 8], 引起细胞功能改变[ 9, 10, 11]。这就意味着在生物材料表面设计合适的几何微结构来调控细胞行为有可能比单纯改变生物材料的化学组分产生的影响更明显。因此, 近年来, 探索生物材料表面的微纳尺度的细胞效应已成为改性生物材料最重要的研究方向之一。
尽管人们已在适合于微纳加工的高分子聚合物和单晶硅表面制作出了包括沟槽, 凹坑, 凸柱, 台阶等多种有序微纳图案, 开展了生物材料微尺度细胞效应研究[ 12, 13]。可是, 在生物陶瓷表面研究细胞的微尺度效应却在近几年才见有报道, 其主要原因是很难用常规的微加工技术在硬而脆的陶瓷表面制作规则有序的微结构, 目前已报道的方法大致有五种: (1)图案模板涂层法: 在微图案化的基底上溅射沉积羟基磷灰石涂层[ 14, 15]。这种涂层化的微图案在一定程度上也能体现HAP微图案的特性, 但却因涂层和基底间固有的化学和应力方面的差异而使其存在化学和物理界面, 而且长时间溶液浸泡还可能导致涂层脱落。(2)微印刷法[ 16]: 以弹性良好的聚二甲基硅氧烷(PDMS)为印模, 将含羟基磷灰石颗粒的悬浮液作为墨汁印刷到基底上。(3)直接打印法[ 17]: 用微机械装置喷涂/打印含羟基磷灰石颗粒的粉体/悬液/膏体。(4)机械加工法[ 18]: 用金刚石微刀直接在陶瓷表面雕刻图案。(5)激光刻蚀法[ 19]。后三种方法都需要精密复杂的制作设备, 不易在普通实验室推广。因此, 发展一种简便的陶瓷表面微图案制作方法是十分必要的。
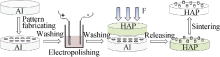
本文报道了一种简易的在HAP基底上制作微图案的方法: 即用超声驱动微探针在铝合金表面雕刻沟槽图案, 并将图案转移到密实的HAP表面。应用这种方法, 我们成功地在羟基磷灰石陶瓷表面制作了三种沟宽(20、40、60 μm)的有序沟槽图案。并且对微图案的形貌、相成分和水接触角进行表征。此外, 本课题组还初步考察了沟槽化的HAP表面对成骨细胞的早期行为(接触引导和增殖)的影响。
图1为本实验室组建的微细图案超声加工系统,主要由超声波发生器, 压电陶瓷换能器(振动频率20 kHz, 振幅1~5 μm), 精密三维位移台和视频显微镜组成。
该微图案超声加工系统使用的雕刻工具为自制的钨丝探针(尖端直径<10 μm, 由钨丝经电化学腐蚀制得), 并被固定在变幅杆的底端。当开启超声波发生器时, 压电陶瓷换能器产生的高频振动经变幅杆传递到钨探针尖端引起针尖发生同频上下振动(振幅可达1~5 μm)。当这种高频振动的探针与硬度小于钨的固体表面接触时, 针尖的高速冲击会在固体表面留下凹痕。当这种振动的探针和固体表面作相对运动时, 固体表面就会留下沟槽痕迹。因此, 只需控制探针或固体的运动轨迹, 就可在二维平面内制作多种图案。本实验使用三维位移台(重复精度5 μm)控制固体的运动轨迹, 同时通过视频显微镜精确控制探针与固体表面的接触状态。
1.1.1 沟槽图案制作
本实验选用了硬度小于钨的铝合金作为图案模板材料。将铝合金板加工成圆片状(φ13 mm× 1.5 mm), 并将铝圆片在单轴压片机上以4 MPa压力预压5 min后, 分别用石油醚(成都市科龙化工试剂厂)和丙酮(成都市科龙化工试剂厂)超声清洗15 min, 自然干燥后固定在三维位移台上。实验设计了三种尺寸的有序沟槽, 沟槽底部宽度分别为20 、40 和60 μm, 分别标记为HAP20、HAP40和HAP60。图案面积均为2.5 mm×1.5 mm, 且同一模板上制作三个相同的图案区作为平行对照用。采用电化学抛光方法去除雕刻后铝模板图案区残留的铝合金颗粒和毛刺, 电化学抛光的条件为[ 20]: 15℃, 无水乙醇-高氯酸(成都市科龙化工试剂厂)混合液(体积比4:1), 恒电压15 V, 抛光时间3 min。
1.1.2 图案转移
将抛光后的铝合金模板置于单轴压片机模具(φ13 mm)内, 加入适量的羟基磷灰石粉体(四川大学生物材料中心提供), 在4 MPa压力下保压2 min, 解压脱模, 这时铝合金模板上的沟槽图案就转移到压实的HAP圆片的表面。将这些带有图案的圆片坯体在60℃烘箱中保温烘干后, 再置入马弗炉(LH15/14, Nabertherm GmbH, Germany)中, 以 5 ℃/min的速率, 在1100℃下烧结2 h。烧成的HA陶瓷片分别用无水乙醇和去离子水超声清洗后烘干待用。整个图案制作过程如图2所示。
1.1.3 图案化HAP表面物性表征
扫描电子显微镜(SEM, Hitachi S-4800, Japan)用于检测沟槽图案的形貌和尺寸; X射线衍射仪(XRD, XD1000, China)用于分析HAP表面的相组成; 接触角测定仪(DSA100, KRUSS, Germany)用于分析图案区表面能的变化, 测试液体为蒸馏水, 测试温度为25℃。
将表面图案化的HAP和对照用表面光滑的HAP陶瓷圆片置于高压灭菌锅内121℃灭菌后, 按每组三个平行样分别置于24孔培养板内。把长势良好的MC3T3-E1成骨细胞用0.25%胰酶(成都哈里生物制品公司)消化, 用DMEM培养液(GIBCO, America)配成浓度为5×104个/mL细胞悬液, 按 1 mL/孔的量分别接种到HAP圆片的表面。培养板在超静台内静置30 min后放入培养箱内, 培养温度为37℃, 5% CO2气氛。
1.2.1 细胞染色和脱水
到达预定的时间点后取出培养板, 弃培养液, 用PBS洗3次; 再用预先配制好的细胞核特异荧光染色剂4',6-diamidino-2-phenylindole (DAPI, molecular probes, USA) 工作液500 μL清洗一次, 然后用工作液覆盖样品, 在37℃、5%的CO2培养箱中孵育15 min; 弃去工作液, 用甲醇(成都市科龙化工试剂厂)洗一次; 样品置于倒置荧光显微镜 (Leica CTR4000, Japan)下观察照相。
细胞在进行扫描电镜观察前需要进行预处理。细胞和材料共培养12 h后, 弃掉培养液, 用2.5%戊二醛溶液(成都市科龙化工试剂厂)固定过夜。用25%、50%、70%、90%、100%的乙醇逐级脱水各一次, 再用无水乙醇(成都市科龙化工试剂厂)脱水两次, 每次5 min。样品进行CO2临界点干燥、喷金后用扫描电镜观察细胞状况。
1.2.2 细胞取向角统计和分析
用图像分析软件(Image Pro 6.0, NIH, USA)对细胞的荧光显微照片进行统计分析, 统计参数包括细胞取向角(Orientation angle, OA)和单位面积细胞数量。细胞取向角的测量方法是: 先沿沟槽方向画一条直线, 再以细胞核的长轴(类椭圆形的长轴)画直线, 然后取两条直线之间的夹角作为细胞核取向角, 将照片中所有细胞核作上述测量和统计分析; 细胞数量的统计是将荧光照片中的细胞核计数, 然后根据照片的尺寸面积计算单位面积内的细胞数量。
图3列出了三种图案化和一种未图案化的HAP圆片表面的SEM照片。从图中可以看出, 沟槽图案规则而均匀。通过图像分析软件对SEM照片进行了测量统计, 以得到三种沟槽的实际尺寸, 其结果列于表1中。表征沟槽尺寸的参数为: 沟槽底宽, 沟槽深度(脊的高度)和脊顶宽。从表1的第一列数据可以看到: 设计沟槽宽度为20、40和60 μm的样品的实测数值分别为(20.53 ± 0.99)、(37.29 ± 3.05)和(61.37 ± 4.01) μm, 两者吻合很好。三种尺寸的沟槽的深度基本相同(~10 μm)。这表明本实验采用的超声探针模板制作和图案转移方法用于HAP陶瓷表面微图案化是有效的。
 | 图3 图案化和未图案化的HAP表面SEM照片Fig. 3 SEM images of topographical patterns of grooved (a, b and c) and unpatterned (d) HAP discs(a) HAP20; (b) HAP40; (c) HAP60; (d) Un-patterned HAP(R:ridge, C:channel) |
| 表1 三种尺寸的沟槽特征参数 Table 1 Sizes of groove patterns on HAP discs |
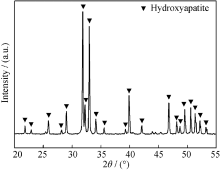
为了考察图案转移过程中是否有其它元素残留在HAP表面, 对微图案化的HAP陶瓷表面作了XRD衍射分析。如图4所示, 所有的衍射峰与羟基磷灰石标准卡片(JCPDS 09-0432)上的衍射峰完全对应, 未发现有其它杂峰。这表明整个图案制作过程中并没有引入杂质相, 确保了HAP表面图案化后化学成分未受影响。因此, 采用本实验方法制作的图案与基底之间不存在化学和物理界面。
液体的接触角测量是判断固体表面对该液体润湿程度的通用方法。清洁固体表面的润湿性主要由其化学组分和表面几何结构共同决定。当固体表面的化学成分不变时, 其润湿性则由表面的几何结构(或粗糙度)所控制[ 21, 22]。一般而言, 密实型HAP具有亲水性, 但其亲水的程度与其表面状态密切相关。
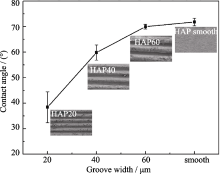
图5显示了纯水在沟槽化和未沟槽化HAP表面的接触角测量结果, 从图中可以看出, 未沟槽化(光滑的)的HAP表面纯水的接触角约为72°, 沟槽化的HAP表面的接触角都小于72°, 且随沟槽宽度的减小, 接触角也明显变小。此外, 沟宽为60 μm的表面水接触角(70°)非常接近未沟槽化的光滑表面的接触角(72°), 这意味着宽沟槽(>60 μm)化的HAP表面将不再影响水的润湿程度。图5显示出的沟槽化HAP表面纯水接触角随沟槽几何尺寸变化的趋势与Wenzel模型[ 23, 24]预测的水滴在同质的粗糙表面更易铺展相同, 即粗糙表面水的接触角应该小于光滑的表面[ 25]。
沟槽化HAP表面显著改变水的接触角, 这反映了HAP表面能因沟槽化而发生变化。为了考察这种变化是否对成骨细胞行为产生影响, 本研究观察分析了沟槽化HAP表面对成骨细胞早期(~30 h)行为的影响。
已有的研究表明, 固体表面的沟槽结构对细胞有接触引导作用[ 7, 8], 即细胞倾向于沿沟槽方向取向排列。定义细胞取向角(OA)即细胞外形的长轴与沟槽方向之间的夹角[ 26]来表征细胞的这种取向排列特性。如果细胞完全沿沟槽方向延伸, 则它的OA值为0°, 表示沟槽对细胞的接触引导作用最大; 如果细胞在材料表面的取向是随机的, 则其取向角为45°。因此, 细胞取向角越小, 沟槽图案对细胞的引导作用越大。
图6是成骨细胞在沟槽化HAP表面培养12 h后生长形态的SEM照片, 从图中可以看到, 由于HAP表面对成骨细胞良好的亲和性, 成骨细胞培养在HAP表面12 h后, 完全铺展在HAP表面, 导致无法从细胞在HAP表面的扫描电镜照片上区分单个细胞的边界, 更无法判断细胞的取向。为此, 我们对细胞核进行了染色, 发现细胞核的拉伸变形方向与沟槽结构存在相关性; 并且, 最近研究显示, 细胞核能随着细胞外几何沟槽发生取向, 且其形状和体积也随之改变[ 27]。细胞核是直接同细胞骨架相连的, 当细胞受到外界环境因素制约而发生形变时,会引起相应细胞核的形变, 因此, 本研究的细胞取向角实际上指的是细胞核的取向角, 即细胞核的长轴与沟槽方向之间的夹角。
 | 图6 成骨细胞在HAP40表面培养12 h后的SEM照片Fig. 6 SEM image of osteoblasts cultured for 12 h on the surface of HAP40 |
图7显示了成骨细胞核荧光染色照片(a)~(d)和细胞核取向角分布统计的结果(e)~(h)。从图7中的细胞核荧光照片可以看出, 细胞数量在平坦的HAP表面(d)明显多于沟槽化的表面(a)、(b)和(c), 且随沟槽宽度的变窄(从(c)到(a))而减少。这表明, 沟槽化的HAP表面并不利于成骨细胞的贴壁, 这可能与凹凸表面的空间位阻有关。
细胞核取向角分布统计结果(图7(e)~(h))表明, 沟槽化的HAP表面对细胞核的取向产生了显著影响。在沟宽为20 μm的HAP20表面, 细胞核取向角为0°~15°的细胞占了90%以上(图7(e)), 随着沟槽宽度的增加, 细胞核的取向角明显增大, 而且小取向角的细胞所占比例也明显减小。当HAP表面无沟槽(平坦)时, 细胞核没有优势取向, 其取向角在0°~90°范围随机分布(图7(h))。这一现象表明, 成骨细胞能感知HAP表面微米级沟槽结构, 并做出优先沿沟槽方向取向铺展的响应。从材料表面拓扑结构对细胞行为的影响程度来看, 窄沟槽比宽沟槽对成骨细胞核的变形引导作用更强。这种沟槽引导作用与已报道的成骨细胞和成肌细胞在HAP涂层化沟槽表面的行为是一致的[ 15]。
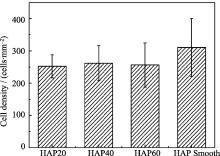
沟槽化HAP表面引导成骨细胞核沿沟槽方向拉伸排列, 这种拉伸作用是否会对成骨细胞的增殖产生影响?为此, 本课题组比较了成骨细胞在沟槽化和未沟槽化的HAP表面培养30 h后的细胞数量的变化(图8), 结果发现成骨细胞数量在未沟槽化HAP表面明显多于沟槽化的表面, 而在三种尺寸的沟槽表面并无明显差别。这表明平坦的HAP表面较沟槽化的表面更有利于成骨细胞的早期附着。其可能的原因有三个: 一是沟槽构成的空间障碍在很大程度上限制了细胞的铺展, 使得细胞之间的交互作用减少, 从而导致细胞增殖速度降低[ 28]; 二是有研究指出, 细胞核的体积和形态对细胞的增殖速率有影响[ 29], 而沟槽化表面上细胞核的形变可能是导致细胞增殖稍慢的一个因素; 三是30 h的培养时间太短。因此, 下一步工作将放在延长成骨细胞培养的时间和成骨类基因表达的检测方面, 以期深入认识沟槽化HAP表面对成骨细胞的行为和功能的影响。
本研究尝试了用超声波驱动钨丝探针在铝合金圆片上雕刻微米级有序沟槽图案后, 再将图案转移到HAP表面的方法, 成功地在HAP表面制作了沟槽宽度分别为20、40和60 μm的有序沟槽图案。这种方法最突出的优点是制作的图案与基底之间没有化学和物理界面, 即图案与基底之间的化学成分相同, 且与基底连结成为一个整体。这为单独考察生物陶瓷材料表面拓扑结构对细胞行为的影响提供了方便。与光滑的HAP表面相比, 沟槽化显著提高了HAP表面对纯水的润湿性, 而且对成骨细胞的铺展产生了沿沟槽方向引导的作用, 沟槽越窄, 这种引导作用越强。但是, 沟槽化的表面在30 h内并没有对成骨细胞的增殖产生显著影响。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|