罗会涛(1985-), 男, 博士研究生. E-mail:luo815923@163.com
使用羧甲基壳聚糖(CMCS)和明胶(Gel)作为粘结剂, 以沉淀法制得的纳米羟基磷灰石(HA)浆料为原料, 采用溶胶-凝胶法制备出了粒径分布均匀, 几何形态良好的致密HA球粒. 其孔隙率为4.7%±0.6%, 单粒抗压强度为(8.9±0.4) MPa(颗粒直径为0.5 mm), 高于孔隙率为16.4%±0.5%的多孔球的抗压强度(7.9±0.2) MPa。仿生矿化和细胞培养的结果显示致密HA球粒具有良好的生物学性能。
By using carboxy methyl chitosan (CMCS) and gelatin (Gel) as adhesive, the nano-HA slurry which was fabricated
羟基磷灰石(HA)具有良好的生物相容性和生物活性, 是骨修复和替换的理想材料[ 1, 2, 3]。但是, 它断裂韧性低(<1 MPa·m1/2)、脆性大, 不利于应用于承重部位[ 4, 5]。因此, 国内外对如何提高烧结后HA的强度进行了大量研究[ 6, 7, 8, 9]。这些研究主要针对如何控制粉末的生产工艺、成分、实验条件及坯体的制备与烧结工艺, 其中重要的一项指标就是初始粉末的粒径大小[ 8, 10]。研究表明, 纳米级HA粉体有利于制备高强度高致密度的HA制品[ 11]。但是由于纳米粒子的表面能很高, 在干燥过程中很容易形成团聚, 从而降低烧结成品的致密度和强度[ 12]。
多种形态(如块状、颗粒状、多孔、致密)的HA陶瓷已经广泛用于各种医学领域[ 13, 14, 15, 16]。有研究发现, 相对于形态不规则的颗粒而言, 具有规则形态的球粒在植入体内后能够减少炎症反应的发生[ 17]。另外, 球粒还具有形态规则、比表面积大、流动性好等优点, 因此HA球粒受到了国内外学者的广泛关注[ 18, 19, 20]。Teng等[ 19]和Wang等[ 20]使用溶胶-凝胶法分别制备了多孔HA球粒和中空HA球粒, 但是其强度受到了限制。高强度的致密HA球粒的制备报道很少。
本工作使用羧甲基壳聚糖(CMCS)和明胶(Gel)作为粘结剂, 沉淀法制备的纳米级HA浆料作为初始原料, 采用溶胶-凝胶法制备了致密HA球粒。使用X射线衍射仪(XRD)、体视显微镜(SM)、扫描电镜(SEM)和透射电镜(TEM)检测烧结后致密HA球粒的组成成分、宏观形态和微观结构。
液体石蜡、羧甲基壳聚糖(CMCS)、明胶(Gel)、戊二醛、柠檬酸三钠、硝酸钙、磷酸氢二铵均为分析纯, 由成都科龙化工试剂厂出品。HA为实验室使用沉淀法合成。α-MEM和胰蛋白酶均为美国Gibco公司生产, 小牛血清为北京元亨圣马公司生产。
采用共沉淀法制备初始HA浆料[ 21]。将所得到的浆料洗涤至pH值为7后分散到100 mL去离子水中, 得到不同浓度(HA含量为10wt%、20wt%、25wt%)的HA悬浮液备用。在80℃, 磁力搅拌下将3 g Gel和1 g CMCS分散到HA的悬浮液中, 加入0.3 g柠檬酸三钠形成分散均匀的混合物后置入真空烘箱中, 在真空度为4 kPa的条件下保持10 min。取出后在机械搅拌的条件下加入到装有液体石蜡的烧杯中形成球粒, 20 min后加入3 mL 50vol%的戊二醛水溶液进行凝胶化, 继续搅拌10 min, 然后将已经凝胶化的球粒滤出, 用去离子水除去液体石蜡和柠檬酸三钠。将洗涤后的球粒按照一定的烧结工艺进行烧结, 即可得到致密HA球粒。
用体视显微镜(Olympus XTL-105)、X射线衍射仪(Philips PW2040/60)、扫描电镜(FEI Quanta 200)分别观察HA球粒的宏观形貌、相成分和微观形貌。测量HA球粒的体积及质量后用密度法测定HA球粒的孔隙率, 公式如下: P=(1- ρs/ ρt)×100% (1)
ρs为HA球粒密度; ρt为HA理论密度。
测量HA球粒干燥前和烧结后的直径, 利用以下公式计算HA球粒的收缩率: S1=(1- D1/ D0)×100% (2)
D1为烧结后HA球粒直径; D0为干燥前直径。
采用中华人民共和国国家标准规定的铁矿球团抗压强度测试方法来测量HA球粒的抗压强度, 具体方法如下: 筛选出单颗直径约为0.5 mm的HA球粒作为样品, 置于Instro5567型材料万能力学试验机的上下压板之间, 然后直接在此球粒上进行加压直至球粒破碎, 加载速率为0.5 mm/min, 重复10次, 然后利用以下公式计算球粒的抗压强度: ω=4 P/π D2 (3)
P为压缩载荷, D为HA球粒的直径。
先将3 g清洗干净的直径约为0.5 mm的HA球粒堆积于多孔不锈钢管中, 然后将钢管置入盛有200 mL快速矿化液(ACS)的广口瓶中, 最后将广口瓶放入37℃恒温保温箱中进行仿生矿化实验, 24 h更换一次ACS矿化液。
将培养到第三代的SD大鼠颅骨成骨细胞用0.25%胰蛋白酶消化制成细胞悬液, 调节细胞密度至1×106个/mL, 每2 g直径约为0.5 mm的致密HA球粒为一组, 堆积至6孔细胞培养板中, 每组接种0.5 mL细胞悬液, 然后补加含15%小牛血清的α-MEM培养基。继续培养3 d后弃去培养基, 用磷酸缓冲液(PBS)冲洗2次, 梯度脱水脱醇处理后临界点干燥, 喷金后用SEM观察致密HA球粒表面上成骨细胞的形貌。
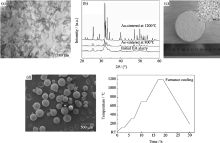
实验采用沉淀法制备的HA浆料由平均长度为100 nm、平均直径为10 nm、纵横比为10的纳米针状物组成, 如图1(a)所示。直接使用HA浆料可以避免干燥和制粉过程, 这不但可以大大减少操作工艺和生产成本, 而且还可以避免干燥过程中纳米粒子的团聚, 从而保证使用的原料是真正意义上的纳米粒子。HA球粒的XRD衍射峰(图1b)与HA标准卡片(JCPDF 74-0566)的衍射峰符合, 没有出现杂峰, 这说明在制备和烧结的过程中没有发生导致HA结构分解反应, 也没有残留有机物。另外, XRD图谱还显示初始HA结晶性很弱, 随着烧结温度的升高, HA的结晶性也逐渐增强。
从烧结后HA球粒的光学照片(图1(c))和低倍数的SEM照片(图1(d))可以看出, 实验制备的HA球粒尺寸均一、几何形态良好。使用水溶性的CMCS和Gel作为粘结剂, 既避免使用大量有机溶剂, 又降低了制作成本。使用的粘结剂量对于制备致密HA球粒极其重要, 如果加入量过低, 那么粘结剂溶解后产生的粘性就不足以负载大量的HA浆料; 如果加入的量过高, 那么在烧结过程中消除粘结剂时就会残留下大量的孔隙, 实验之所以加入CMCS和Gel两种有机物, 就是利用了在柠檬酸钠的作用下二者中的-COOH和-OH会发生相互作用而提高粘度, 以达到加入少量粘结剂就可以得到可以负载足够HA浆料的粘度的目的。经过探索, 加入粘结剂的最佳浓度在3%~7%, 实验使用的浓度为4%。
烧结过程对于制备致密HA球粒也非常重要[ 22], 本实验采取的烧结工艺曲线如图1(e)所示。在120℃、320℃、700℃分别保温2 h以保证在除去水和高分子时能给予HA球粒充分的收缩时间。在1200℃保温2 h后随炉降温, 总共烧结时间为19 h。从不同比例的HA的SEM照片(图2)中可以看出, 当HA含量为10wt%时, 得到的HA球为多孔球粒, 孔隙大小为2~4 μm, 从表1中可以看出其孔隙率为16.4%±0.5%。当HA含量提高到20wt%和25wt%时, 其孔隙率分别为8.3%±0.4%和4.7%±0.6%。根据致密HA的定义[ 22], 使用HA含量为25wt%所得到的球粒的致密度已经达到了高于95%的要求。本实验能够得到如此高的HA球粒致密度主要归因于以下三个方面: 第一, 将混合物置入真空系统中除去了其中的气泡, 从而避免产生大孔; 第二, 本方法使用的初始原料为未经过干燥的HA浆料, 从某种意义上说是真正的纳米级粉体, 在烧结过程中可以通过HA的收缩消除粉体间的空隙, 从而在某种程度上减少了微孔的产生; 第三, 相对于HA的含量(25wt%), 加入的有机物含量较少, 因此有机物在分解和燃烧时产生的孔隙较少, 通过收缩可以消除绝大部分此类微孔。
表1显示了使用不同HA比例所得到的HA球粒的性能参数。随着HA含量的提高, 最终得到HA球粒的孔隙率越低, 即致密度越高。从表1中可以看出HA含量对球的收缩率基本无影响, 因此可以推断, 球的收缩率主要是由有机物含量决定的, 而接近60%的收缩率对消除致密HA球粒中的微孔起到了重要作用。
| 表1 不同HA含量的球粒的性能参数 Table 1 Properties of spheres with different HA contents |
另外, 从表1还可以看出, 随着HA含量的增加, 最终得到球粒的抗压强度也随之增大, 致密HA球粒(25wt%)相对于多孔HA球粒(10wt%)在抗压强度方面提高了12.7%。因此实验获得的致密HA球粒在高负载环境下应用将更加具有优势。
致密HA球粒矿化3 d和5 d后, 表面的矿化情况如图3(a)和3(b)所示。由图3可以看出, 浸泡3 d后表面上可以观察到少量絮状生成物, 而在浸泡5 d后, 表面上覆盖了大量均匀的片状矿化层。
 | 图3 (a)矿化3 d, (b)矿化5 d, (c)细胞培养3 d后致密HA球粒表面的SEM照片Fig. 3 SEM images of the surface of dense spheres (a) mineralized for 3 d, (b) mineralized for 5 d and (c) cultured for 3 d |
成骨细胞与致密HA球粒共培养3 d后的SEM照片(图3(c))显示, 细胞在材料表面铺展良好, 具有成骨细胞的梭形形貌特征, 粘附紧密, 生成了正常的伪足等结构。通过仿生矿化实验和细胞培养实验的结果可以说明, 致密HA球粒具有良好的生物活性和生物相容性。
采用溶胶-凝胶法可以有效地制备出孔隙率为4.7%±0.6%, 抗压强度为(8.9±0.4) MPa的致密HA球粒。直接使用沉淀法制备的HA浆料为原料, 可以避免干燥时团聚现象的产生, 在降低制作成本的同时, 还有效地保证了使用的材料为纳米级粉体, 从而更加有利于致密HA球粒的制备。在整个制备过程中, 去气处理是一个很重要的步骤, 缺少此步骤将大大降低产品的致密度。致密HA球粒同样也具有良好的生物学性能, 而且其抗压强度明显高于多孔HA球粒(孔隙率为16.4%±0.5%, 抗压强度为(7.9±0.2) MPa), 使得其更适用于高负载环境中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|




 m and a high specific surface area (SSA) of 63 m2/g. By contrast, a commercial calcined HA (commercial HA) was crystalline and had a median particle size of 5
m and a high specific surface area (SSA) of 63 m2/g. By contrast, a commercial calcined HA (commercial HA) was crystalline and had a median particle size of 5