吴成铁(1978-), 男, 研究员. E-mail:chengtiewu@mail.sic.ac.cn
近年来, 硅酸盐生物活性陶瓷越来越受到研究人员的重视, 其主要原因在于硅酸盐生物陶瓷能够通过释放硅(Si)离子等生物活性离子, 显著地促进骨组织细胞的增殖、分化及骨组织修复. 硅酸盐生物活性陶瓷有望作为新的陶瓷体系广泛应用于骨缺损修复和再生。本文将结合本课题组在过去十年的研究, 重点介绍目前硅酸盐生物活性陶瓷用于骨组织修复及再生的研究进展。同时, 通过与传统磷酸钙类生物陶瓷进行比较, 对硅酸盐生物活性陶瓷的优缺点进行分析和归纳, 最后对硅酸盐陶瓷作为新的生物陶瓷体系用于骨组织修复的前景做了展望。
Silicate bioceramics have received significant attention in the past several years. The main reason is that silicate bioceramics can efficiently stimulate the proliferation, differentiation and gene expression of tissue cells as well as the regeneration of bone tissue by release of Si-containing ionic products. Due to this significant advantage, silicate bioceramics, as a novel bioceramic system, have great potential to be widely used for repairing and regenerating bone tissues. In this paper, our researches in the past ten years are combined and the research advancements of silicate bioceramics are reviewed. The advantages and disadvantages of silicate bioceramics are summarized by comparing with conventional calcium phosphate bioceramics. Finally, a forward-looking perspective for silicate bioceramics on the applications of bone regeneration is also discussed.
生物医用材料是用于生物系统疾病的诊断、治疗、修复或替换生物体组织或器官, 增进或恢复其功能的材料[ 1]。早期人们利用天然材料来修补人体创伤, 随着医学和材料科学的发展, 一些金属材料、无机非金属材料和有机材料如不锈钢、钛合金、贵金属、氧化铝陶瓷、聚四氟乙烯等用来制作人工移植材料, 对延长人类寿命和提高生命质量起到了一定作用。但从医学应用角度来看, 这些材料均属于生物惰性材料, 即与人体组织没有活性结合, 因此在临床应用上存在不少问题和缺陷[ 2, 3]。为了解决上述难题, 选择新型的具有生物活性的医用材料引起了学者们的广泛重视, 并提出了“生物活性”这个概念。“生物活性”来源于上世纪70年代, 当时Hench教授发现一定组成的玻璃界面经过化学反应, 形成了与骨组织间的连接[ 4]。后来, Hench给了“生物活性材料”一个广泛的定义, 即能在界面上产生一定的反应, 导致组织与材料形成键连接的材料[ 5]。在“生物活性”概念的启发下, 国内外科学家研究了一系列的生物活性材料, 比如磷酸钙类陶瓷(羟基磷灰石(Hydroxyapatite)、β-磷酸三钙(β-tricalcium phosphate))、生物活性玻璃 (Bioactive glasses)(包括生物活性玻璃陶瓷)及硅酸钙(Wollastonite)陶瓷等。
磷酸钙类陶瓷, 如羟基磷灰石和β-磷酸三钙陶瓷的显著优点在于他们的组成与骨的矿化相组成非常类似, 这类陶瓷具有比较优良的相容性和成骨传导性, 但磷酸钙类陶瓷的力学强度较低。而且, 近来的研究表明磷酸钙类陶瓷的降解性较缓慢, 特别是烧结后的羟基磷灰石在体内降解非常缓慢[ 6, 7, 8]。生物活性玻璃最早是由Hench教授[ 9]通过高温融化方法制备的。他们的研究显示硅酸盐生物玻璃对成骨细胞的基因表达有刺激作用, 在临床应用中能明显促进骨再生[ 1, 2]。基于硅酸盐生物玻璃的重要研究成果, 他于2002年提出了第三代医用生物材料的概念。第三代生物活性材料在人体生理环境中应具有在分子水平上激发特殊的细胞响应, 能吸附与骨修复有关的活性物质, 并通过在体液环境中释放活性离子, 或通过表面微观结构与宿主(细胞、体液及组织)发生界面反应, 调控机体的自发修复功能, 诱导、促进新骨形成, 是一种具有“主动修复功能”和“可调控生物响应特性”的新型可降解生物活性材料[ 1, 10]。近年来, 随着溶胶-凝胶法在生物活性玻璃材料制备中的广泛应用, 各种具有不同SiO2含量的生物活性玻璃也相继出现[ 11, 12, 13]。但是, 无论是高温熔制法还是溶胶-凝胶法制备的生物活性玻璃材料, 其缺点是块体材料脆性高、抗弯强度和断裂韧性低[ 10]。
相对于磷酸钙类陶瓷和生物活性玻璃, 硅酸盐生物活性陶瓷的研究起始较晚。早在1982年, Kokubo发现A/W生物活性玻璃陶瓷中含有硅灰石(硅酸钙- CaSiO3)相。受到生物活性玻璃陶瓷的启发, 西班牙的De Aza教授[ 14]在上世纪90年代研究了硅酸钙用作生物陶瓷的一些理化特征。从元素组成来看, 硅是动物和人体组织中一种重要的微量元素, 吸收水平直接影响到骨的质量[ 15], 尤其是在幼骨发育阶段, 硅在新骨钙化区域产生“富集”, 并协同钙促进骨组织的早期钙化[ 16]; 如果缺硅, 新生骨会发生畸变[ 17]。因此, 考虑到硅元素在人体的重要作用, 在过去的十年中人们对硅酸盐生物陶瓷用作骨修复做了系统的研究。研究发现某些硅酸盐陶瓷相对于传统的磷酸钙陶瓷在力学、降解性及生物学效应方面都表现出了独特的优点。而且, 通过发展新型的硅酸盐生物陶瓷, 有望克服第一代惰性陶瓷和第二代不降解的生物活性陶瓷的不足。随着分子生物学和骨组织工程学的发展, 目前的研究主要集中在发展第三代具有特定活性组成和结构的生物陶瓷, 这就要求新的生物陶瓷具有在分子水平上激发特殊的细胞响应的功能。研究发现某些硅酸盐生物陶瓷的确具有这方面的功能, 这为进一步研究第三代生物活性陶瓷材料提供了新思路和新思想。然而目前还没有文章对硅酸盐陶瓷作为骨修复材料进行综合、系统地报道和展望。因此, 本综述将对硅酸盐生物活性陶瓷的种类、制备方法、力学性能、矿化行为、细胞相容性以及在骨组织工程和骨修复中的应用作较详细的介绍。
自从上世纪90年代硅酸钙陶瓷作为生物活性材料研究以来, 一系列具有不同组成的硅酸盐生物活性陶瓷被陆续制备出来(表1)。在两元组成中, 主要有CaO-SiO2、MgO-SiO2、SrO-SiO2、ZnO-SiO2等硅酸盐体系陶瓷; 在三元组成中, 主要有MgO-CaO-SiO2、ZnO-CaO-SiO2、SrO-CaO-SiO2、TiO2-CaO-SiO2、ZrO2-CaO-SiO2、 P2O5-CaO-SiO2、SrO-MgO-SiO2、SrO-ZnO-SiO2及Na2O-ZnO-SiO2等体系; 在四元组成中, 主要有SrO-ZnO-CaO-SiO2体系陶瓷。而在同一体系中, 可能具有不同组成的硅酸盐生物陶瓷。表1概括了目前主要研究的硅酸盐生物陶瓷类型和相应的制备方法。相对于磷酸钙类陶瓷, 硅酸盐陶瓷具有更广泛的组成。
| 表1 硅酸盐生物陶瓷类型及合成方法 Table 1 Silicate ceramics and preparation methods |
目前硅酸盐生物陶瓷的制备方法主要有溶胶-凝胶法、沉淀法和固相反应法。对于二元氧化物组成的硅酸盐陶瓷, 因为结构相对简单, 可以用不同的方法来合成比较纯的陶瓷材料。然而, 对于三元氧化物组成的硅酸盐陶瓷, 由于其组成相对复杂, 在合成过程中很容易产生不纯的杂质相, 因此就需要对合成体系精细控制, 包括方法的选择、化学试剂的使用和反应条件的控制。整体来讲, 大多数三元和四元氧化物组成的硅酸盐陶瓷, 比较理想的方法是采用溶胶-凝胶法合成。溶胶-凝胶法能够提供比较均匀(分子水平)的反应体系, 有利于各组分间进行充分的反应, 从而生成具有特定组成的硅酸盐陶瓷。而且, 相对于固相反应法, 溶胶-凝胶法合成多元硅酸盐陶瓷的煅烧温度较低。
生物活性陶瓷常被用作骨科植入材料, 而人体骨骼系统处于复杂的应力环境, 因此植入材料必须有足够的力学强度并能与宿主骨形成牢固的结合。在生物陶瓷材料研究中, 材料的物理性能(相组成、收缩性和致密度等)和力学性能(抗压强度、抗弯强度、弹性模量和断裂韧性等)直接决定生物陶瓷的加工条件和应用环境。良好的生物陶瓷, 其力学性能应当与植入组织相匹配。多数场合下, 要求材料具有低的弹性模量[ 89, 90, 91]。材料的弹性模量过高, 在材料/组织界面区域容易发生应力屏蔽而导致骨的吸收[ 92]。因此, 生物陶瓷应具有与人体皮质相似的弹性模量。同样, 材料的韧性也是一个重要的因素。表2对硅酸盐陶瓷力学性能与羟基磷灰石、及人体皮质骨的力学性能进行了比较。传统的钙-磷类陶瓷由于受到其力学强度(特别是断裂韧性)的制约, 只能用于一些非重力承受部位, 限制了其广泛应用[ 84]。而某些硅酸盐陶瓷如常规烧结的透辉石(Diopside)和硅酸二镁(Dimagnesium Silicate)陶瓷具有比羟基磷灰石陶瓷更高的抗弯强度。而大多数硅酸盐陶瓷的抗弯强度都跟人体致密骨的抗弯强度接近。硅酸二镁、硅酸三钙(Tricalcium Silicate)、以及钙-镁-硅体系等陶瓷的断裂韧性高于羟基磷灰石陶瓷的断裂韧性。相对于羟基磷灰石陶瓷, 硅酸盐陶瓷的弹性模量更低一些, 更接近人体致密骨的弹性模量。通过一些特殊的烧结方式, 如放电等离子体快速烧结方法, 能够显著地提高硅酸盐陶瓷的致密度, 并大幅度提高其力学强度, 达到人体致密骨的强度水平。而且由于硅酸盐陶瓷具有相对大范围的化学组成, 其不同的化学组成对陶瓷力学性能的调控具有重要影响。
| 表2 硅酸盐生物陶瓷的力学强度 Table 2 The mechanical properties of silicate bioceramics |
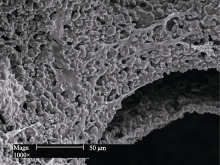
生物活性陶瓷植入人体后, 在组织液的调控下材料与组织界面发生一系列化学反应并形成类骨磷灰石过渡层, 使材料与骨组织形成牢固的化学键合, 提高修复效果[ 2, 93]。文献报道, 可以在体外构建的模拟体液中对生物陶瓷的活性水平进行评价[ 94]。表3对目前系列硅酸盐生物陶瓷在模拟体液中诱导类骨磷灰石的矿化能力进行了比较。一般地, 硅灰石、硅酸二钙 (Dicalcium Silicate)、硅酸三钙和白硅钙石 (Bredigite) 等具有非常优良的类骨磷灰石矿化能力。而镁黄长石(Akermanite)、镁硅钙石(Merwinite)和钙磷硅酸盐(Silicocarnotite)具有较好的磷灰石矿化能力。透辉石、钙镁橄榄石(Monticellite)和硅锆钙石(Baghdadite)具有较弱的矿化能力。硅酸二镁等硅酸盐陶瓷几乎不具有磷灰石矿化能力。图1列出了镁黄长石和白硅钙石陶瓷的磷灰石矿化的扫描电镜(SEM)照片。可以清晰地看出, 在硅酸盐陶瓷表面出现了纳米磷灰石矿化和结晶[ 49, 58]。通过分析发现, 材料的组成对硅酸盐陶瓷的矿化能力有着重要的影响。钙含量高的硅酸盐陶瓷具有较高的矿化能力, 而钙含量低的或不含钙的硅酸盐陶瓷具有较低的矿化能力。在二元钙-硅基陶瓷中引入第三种元素, 比如Mg、Zn、Ti和Zr等会明显降低其矿化能力[ 51, 75, 79]。而且, 研究发现, 硅酸盐陶瓷的矿化能力与其本身固有的溶解性有很大关系, 一般来说, 溶解性高的材料其矿化效果更好[ 51]。
 | 图1 纳米磷灰石在镁黄长石(a)和白硅钙石陶瓷(b)表面矿化的SEM形貌Fig. 1 SEM images of apatite mineralization on the surface of akermanite and bredigite bioceramics |
| 表3 硅酸盐生物陶瓷的磷灰石矿化能力 Table 3 Apatite-mineralization ability of silicate bioceramics |
对硅酸盐陶瓷在模拟体液中的矿化机理的研究表明, 在浸泡过程中, 硅酸盐陶瓷先溶出Ca2+离子, 并与SBF中的H+进行离子交换, 在材料的表面形成Si-OH层, 由于Si-OH层带有负电荷, 吸引溶液中带正电的Ca2+离子, 并形成无定形的Ca-Si层, 带正电荷, 再吸引溶液中带负电荷的HPO42-离子形成无定形Ca-P化合物, 随之成核、结晶并生长成磷灰石(图2)[ 58, 95, 96]。
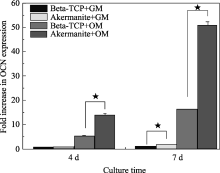
硅酸盐生物活性陶瓷除了其独特的矿化能力外, 其溶解出的离子产物能够显著地促进组织细胞的增殖、分化甚至相关基因表达。通过系统研究硅酸盐体系陶瓷的浸提液对成骨细胞(OB)、骨髓基质干细胞(BMSCs)、L929成纤维细胞(L929)、脂肪干细胞(ADC)以及牙周细胞(PDLC)的增殖和分化的影响, 发现大部分硅酸盐陶瓷材料的离子产物能够明显地提高这些细胞的增殖和分化效果, 但传统的羟基磷灰石的离子产物并没有这样的促进作用。这些研究说明, 硅酸盐陶瓷通过释放Si等离子产物, 可有效提高细胞活力和细胞分化, 证明其在组成上具有优良的细胞活性。表4概括了目前主要的硅酸盐陶瓷的离子产物对细胞活性的促进作用。可以看出, 镁黄长石陶瓷能够对四种不同细胞的增殖和分化起明显的促进作用(见图3), 因此可以认为该陶瓷在一定程度上具有体外的成骨诱导性。虽然目前还不清楚其促进作用的具体机理, 但可以推断硅酸盐陶瓷通过释放含Si的离子产物对细胞成骨相关信号通路可能起一定的活化作用。
| 表4 硅酸盐陶瓷的离子产物对各种不同类型细胞的增殖和分化的促进作用 Table 4 The stimulation of different types of tissue cells by ionic products from silicate bioceramics |
为了进一步评价硅酸盐陶瓷的细胞相容性, 本课题组对硅酸盐陶瓷致密块体材料与细胞的作用做了较深入的研究。总体来讲, 较低溶解性的硅酸盐陶瓷致密块体材料具有较好的细胞相容性, 如镁黄长石[ 52]、透辉石[ 51]、锌黄长石(Hardystonite)[ 71]、榍石(Sphene)[ 75]、硅锆钙石[ 79]、锶镁黄长石(Strontium- akermanite)、锶锌黄长石(Strontium- hardystonite)以及硅酸二镁[ 36]等。这些陶瓷能够支持成骨细胞的粘附 (图4)、增殖、分化和基因表达。而溶解较快的硅酸盐生物活性陶瓷块体材料, 如硅灰石、硅酸二钙、硅酸三钙和白硅钙石的细胞相容性相对于溶解性较低的硅酸盐陶瓷要差[ 70, 75, 79]。其中一个主要原因在于溶解较快的硅酸盐陶瓷块体材料会导致细胞培养液的pH值快速上升, 高的pH 环境对细胞往往都有明显的抑制作用[ 37, 93]。
 | 图4 成骨细胞在镁黄长石(a)和榍石陶瓷(b)上粘附和生长Fig. 4 Osteoblast attachment and growth on the akermanite (a) and sphene (b) ceramics |
与传统的β-磷酸三钙陶瓷比较来看, 某些特定组成的硅酸盐陶瓷块体材料(如典型的含钙、镁和硅的镁黄长石陶瓷)相对于β-磷酸三钙陶瓷具有显著提高成骨细胞增殖、分化和特定成骨基因表达的能力[ 52]。镁黄长石陶瓷不仅能提高成骨细胞的成骨分化能力, 而且对其他类型的细胞也有诱导成骨分化的功能。进一步研究发现, 镁黄长石相对于β-磷酸三钙陶瓷明显地提高了脂肪干细胞的成骨分化[ 54]。而且也显著地促进了牙周细胞的增殖和成骨类基因表达[ 56]。这些研究初步证实了某些特定组成的硅酸盐陶瓷的确比传统的钙磷类陶瓷材料具有更好的促进细胞分化的能力, 显示了硅酸盐陶瓷独特的细胞活性。
自固化材料最突出的优点是材料具有任意塑形能力, 可以对任意形状缺损填充修复。硅酸二钙和硅酸三钙是波特兰水泥的主要成份之一, 具有水化特性。其糊状物的自固化性质与材料中硅酸根离子的水化聚合有关。硅酸二钙和硅酸三钙与水接触时, Ca2+及SiO44-很快进入溶液, 颗粒表面形成Si-O网络, 随后一种纳米的无定形水合硅酸钙(CSH)凝胶沉积原始颗粒表面, 同时Ca(OH)2晶体成核、生长并聚集在凝胶毛细孔区域[ 94, 95]。随着水化时间的延长, CSH凝胶聚合、硬化。研究表明硅酸二钙和硅酸三钙不仅具有优良的水化和自固化性能, 而且还具有优良的磷灰石矿化能力和对细胞增殖的促进能力。这些优点决定了硅酸二钙和硅酸三钙有可能作为一种可降解的自固化骨水泥用于骨修复[ 28, 31]。而且与半水石膏复合, 可以提高硅酸二钙和硅酸三钙骨水泥的力学强度, 减小凝固时间[ 34, 96, 97]。与磷酸氢钙等磷酸盐类材料复合可以降低硅酸三钙的碱性水平和固化时间, 同时提高其细胞相容性[ 98, 99]。进一步研究发现硅酸二钙和硅酸三钙还可以作为药物释放载体, 对装载的庆大霉素有缓慢释放功能[ 34]。虽然磷酸钙类骨水泥也具有比较好的骨传导性, 但材料本身诱导类骨磷灰石矿化沉积能力差, 与骨组织键合强度不如钙-硅基生物活性材料[ 100, 101]。从临床应用的角度分析, 理想的自固化材料除了生物相容性好, 还应具有优良的生物活性和降解性, 通过自身化学成分对细胞产生刺激, 促进细胞增殖、分化并引导新生骨组织在材料降解形成的空间快速生长。初步研究表明硅酸三钙类材料通过与其他材料的复合显示出良好的可注射性、类骨磷灰石矿化性、可降解性及细胞生物活性。因此, 硅酸三钙及其复合材料可望为骨微创注射治疗创造条件。
因为硅酸盐陶瓷具有优良的细胞活性, 这类陶瓷在骨组织工程应用中也显示出很好的前景。目前, 主要对硅灰石、镁黄长石、透辉石和白硅钙石等可降解的硅酸盐陶瓷多孔支架在骨组织工程中的应用进行了研究。用于制备硅酸盐生物陶瓷支架的方法主要有造孔法[ 102, 103]、聚合物海绵模板法以及三维打印法[ 24, 50, 64, 104]。其中, 造孔法制备的硅酸钙支架具有较高的力学强度, 可以达到112 MPa, 但缺点是孔隙率和孔连通性不够, 而且孔形貌不够规整[ 103]。聚合物海绵模板法能够显著提高硅酸盐陶瓷支架的孔隙率和连通性, 但力学强度不高。最近, 本课题组通过三维打印方法制备了硅酸盐陶瓷支架, 具有比较高的力学强度和可控的孔结构。图5显示了采用聚合物海绵模板法和三维打印法制备的硅酸盐多孔陶瓷支架。
 | 图5 用聚合物海绵法(a)和三维打印法(b)制备的硅酸盐陶瓷支架照片Fig. 5 Silicate bioceramic scaffolds prepared by polymer sponge template (a) and 3D-printing (b) method |
对硅酸盐陶瓷支架的体外细胞相容性研究发现, 硅灰石、镁黄长石、透辉石和白硅钙石等支架能够支持细胞的粘附、增殖和分化。成骨类细胞能够通过支架中的大孔结构有效地长入多孔支架的内部 (图6)。随后, 把硅灰石和镁黄长石陶瓷支架植入兔子的颅骨和股骨缺损中, 4~8 w后组织切片观察发现硅灰石和镁黄长石支架具有比β-磷酸三钙陶瓷支架更快的体内降解性和成骨能力[ 8, 53]。镁黄长石陶瓷不仅能够诱导新骨的生长, 而且还能够促进体内血管的形成[ 57]。这些体外、体内研究初步证实了硅酸盐陶瓷在发挥主动骨修复功能的独特效果, 为进一步建立新型的硅酸盐生物陶瓷体系奠定了基础。虽然目前人们对含硅的磷酸盐生物材料做了很多研究, 但是, Bohner认为硅离子在磷酸盐生物陶瓷中的具体作用及相关机理还不是很清楚[ 105]。同样, 硅酸盐生物陶瓷在成骨和成血管方面表现出了一系列的优越性, 但其背后的机理还有待进一步深入探讨。但目前, 通过本课题组的研究可以初步认为, 这些优良生物学性能可能与以下几个因素有关: (1)硅酸盐生物陶瓷内部的Si-OH团是诱导其快速矿化的主要原因; (2) 其释放的硅酸根离子对促进干细胞的成骨分化及体内成骨、成血管具有重要的影响; (3)如Mg、Zn、Sr等引入到硅酸盐陶瓷中, 对于调节其理化和生物学性能也具有重要作用。
本文综述了硅酸盐生物陶瓷的最新研究进展, 包括目前主要研究的硅酸盐生物陶瓷的种类、合成方法、力学性能、类骨磷灰石矿化能力、细胞相容性以及作为生物活性自固化骨水泥和骨组织工程支架在骨修复中的研究, 并归纳了这些不同类型的硅酸盐生物陶瓷的组成对其理化性能和生物学效应的影响。同时, 通过与传统磷酸钙类生物陶瓷的比较, 发现某些硅酸盐生物陶瓷具有比磷酸钙类陶瓷更优越的力学性能、降解性和成骨性能。其中, 硅酸盐生物陶瓷具有两个非常显著的特点: 1)硅酸盐陶瓷具有诱导骨髓基质干细胞、脂肪干细胞、牙髓细胞和牙周细胞等多种干细胞的成骨分化能力; 2)硅酸盐陶瓷能够显著地诱导成血管化。众所周知, 如何有效地提高生物材料的成骨诱导性和成血管化一直是生物材料研究的难题, 硅酸盐生物陶瓷可能为解决这些问题提供新的途径。另外, 目前普遍认为发展第三代生物材料是生物材料研究的一个共同目标, 其要求生物材料在人体生理环境中应具有分子水平上激发特殊细胞的响应, 能调控机体的自发修复功能, 从而能诱导、促进新骨形成。硅酸盐生物陶瓷在一定程度上已被证实的确具有在基因水平上激活细胞响应和促进新骨形成的能力, 因此可以认为, 硅酸盐生物陶瓷是第三代生物活性材料的典型代表之一。而且, 由于硅酸盐生物陶瓷相对广泛的化学组成, 为调控和优化材料的理化性能和生物学效应提供了很好的选材基础。可以相信, 通过深入而系统的研究, 硅酸盐生物陶瓷有望在不久的将来奠定好临床应用基础。为实现这个目标, 以下几个方面还需要进一步深入研究。首先, 从分子和基因水平上深入研究硅酸盐生物陶瓷促进细胞响应的生物学机制; 第二, 目前对硅酸盐生物陶瓷的体内研究还主要集中在小动物模型上, 下一步需要通过大动物实验进一步研究这些材料的成骨、成血管化和降解能力; 第三, 深入研究硅酸盐生物陶瓷的体内成骨、成血管化和降解性机制。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|
| [96] |
|
| [97] |
|
| [98] |
|
| [99] |
|
| 100 |
|
| 101 |
|
| 102 |
|
| 103 |
|
| 104 |
|
| 105 |
|