林 才(1969-), 男, 副主任医师. E-mail:lincai0577@hotmail.com
采用熔融法和溶胶-凝胶法分别制备了生物活性玻璃45S5和SGBG, 通过SEM、BET及XRD等方法对它们的微观结构进行了表征, 并建立了SD大鼠糖尿病皮肤创面模型, 通过对创面愈合时间、创面愈合率以及HE染色分析, 探讨了生物活性玻璃对促进糖尿病难愈创面愈合的效果。结果表明, 与凡士林组相比, 生物活性玻璃组能加速创面愈合, 且SGBG具有纳米结构, 其比表面积更大, 与45S5相比能缩短糖尿病创面的愈合时间, 提高愈合速度。组织学分析表明生物活性玻璃能促进肉芽组织的生长。由此表明生物活性玻璃能促进大鼠糖尿病创面的修复, 且具有纳米结构的SGBG效果更好。
The 45S5 bioactive glass (45S5) was prepared by a melting process, while sol-gel bioactive glass (SGBG) was obtained by Sol-Gel method. The bioactive glasses were characterized by SEM、BET and XRD. Then the wound healing effect was investigated through the wound healing time, wound healing rate and histology examination. The results indicate that the bioactive glass can lessen the wound healing time and increase the healing rates of diabetic rats. Compared with the 45S5, SGBG can promote wound healing of diabetic rats more quickly and efficiently due to the larger surface area and nanostructure. Histological examination shows that bioactive glasses promote the proliferation of fibroblasts and growth of granulation tissue. All results suggest that bioactive glass can accelerate the recovery of skin wounds and SGBG with nanostructure has a better healing effect in diabetes- impaired models.
糖尿病(DM)是一组由多种病因引起的以慢性高血糖为特征的代谢性疾病群[ 1]。糖尿病难愈创面是影响糖尿病人群健康状况和生活质量的重要原因之一, 因此开发一种能加速糖尿病难愈创面愈合的材料一直是研究者关注的焦点。
自Hench教授于1969年研制成功生物活性玻璃以来, 经过近三十年的研究, 证明了生物活性玻璃具有良好的生物活性和骨修复功能[ 2, 3]。后来还发现45S5生物活性玻璃与软组织也能很好结合, 并可促进皮肤等软组织的再生[ 4, 5]。此外, 生物活性玻璃能够促进成纤维细胞增殖, 并刺激血管内皮生长因子(VEGF)的表达和蛋白分泌[ 6, 7, 8]。基因芯片研究发现其能激活具有造血功能的CD44抗原形成前体、成纤维母细胞生长因子受体(N-sam)和血管细胞粘附蛋白(V-CAM1)等对创面修复起关键作用的基因[ 9]。同时, 它还有一定的抗菌功能[ 10]。因此, 生物活性玻璃将给难愈创面的治疗带来新的希望。
研究表明, 生物活性玻璃(Bioactive glass, BG)的生物活性与离子溶出量和比表面积相关[ 11]。本研究通过溶胶-凝胶法制备了具有更高比表面积的新型生物活性玻璃, 并研究了将其应用于糖尿病大鼠创面后产生的生物学反应及愈合效应, 以便对其创面修复作用进行更深入的理解。
所用原料二氧化硅, 磷酸三钙, 碳酸钙和碳酸钠、盐酸、正硅酸乙酯(TEOS)、磷酸三乙酯(TEP)和四水硝酸钙等均为分析纯级, 购于光华化学有限公司(广东, 汕头)。链脲佐菌素(streptozotocin, STZ)购于sigma。
生物活性玻璃45S5(摩尔组成: 46.1% SiO2, 24.4% Na2O, 26.9% CaO, 2.6% P2O5)通过熔融法制备[ 12], 溶胶-凝胶生物活性玻璃SGBG通过溶胶-凝胶法制备(摩尔组成: 60% SiO2, 36% CaO, 4% P2O5)。按照一定比例依次将每种原料加入烧杯后搅拌1h制成均匀溶胶, 在室温下陈化72 h, 使水解-缩聚反应充分进行, 形成凝胶。将凝胶置70℃和150℃的鼓风干燥箱中分别干燥72和48 h, 将得到的凝胶块在700℃的箱式电阻炉内热处理3 h。将两种材料球磨, 过筛, 选取粒径≤53 μm的生物活性玻璃粉末, 分别将其加入80℃水浴加热致其融化在液体的凡士林中, 以一定比例混合均匀, 冷却后既可得到软硬适当的膏剂, 干热灭菌法灭菌备用。膏剂分别标记为45S5和SGBG。
生物活性玻璃的理化性能采用Panlytical公司生产的XpertPRO X射线衍射仪(Cu-K α射线)分析试样的相结构; 采用德国LEO公司生产的LEO1530VP扫描电子显微镜(SEM)观察试样的显微结构; 采用Micromeritics公司的ASAP2010比表面积测试仪(BET)对材料的比表面积、孔径分布等进行表征。将0.3 g生物活性玻璃浸泡在200 mL模拟体液(SBF)中考察pH的变化。
实验动物选用温州医学院实验动物中心提供的雄性SD大鼠, 体重180~220 g。实验前12 h禁食, 按65 mg/kg腹腔注射STZ。SPF级环境饲养2 w后, 测定血糖大于16.7 mmol/L时, 认为糖尿病模型制备成功。实验当日, 取用250 g左右已成模的糖尿病大鼠, 以30 mg/kg戊巴比妥钠腹腔注射麻醉大鼠, 再将大鼠背部脱毛, 生理盐水清洗, 碘伏擦试消毒。以脊柱为中线, 制作四个直径为1.8 cm全层切除皮肤的创面。以双盲随机法分别采取膏剂45S5、SGBG和凡士林外敷创面, 即实验组分为45S5和SGBG组, 对照组为白凡士林(V)。外用纱布覆盖固定, 隔天换药。
术后各时间点观察伤口愈合情况, 以创面完全上皮化、无渗出作为创面愈合的依据, 记录创面愈合时间。用照相、透明膜描记法记录创面面积, 计算创面愈合率。创面愈合率= [(原始创面面积-未愈合创面面积)/原始创面面积]×100%。术后7、14 d取材, 采取从创面部位切除全层组织的方法, 10%福尔马林固定, 进行HE染色, 观察组织变化。
定量结果均采用平均值±标准差表示, 所得数据均用SPSS 16.0统计软件进行统计学处理, 所有实验组间差异用单因数方差分析进行检验, P<0。05有统计学意义。
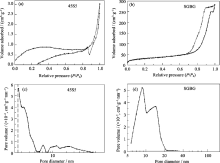
由熔融法制备的45S5(图1(a))结构致密, 且在连续的玻璃相中有分相结构, 显示材料组成和结构具有一定的微不均匀性。这是由于[SiO4]和[PO4]之间的结构、尺寸差异从而导致玻璃液在冷却过程中进行结构网络的重排及各元素在不同相中分布浓度不同所致。SGBG(图1(b))的显微结构和45S5则完全不同, 是由大量纳米级微球组成, 微球直径在15~50 nm, 每个微球又是由尺寸更小的微球团聚而成, 因此SGBG可能具有二级微球结构, 这种结构可增加它的比表面积和液体吸附性能。
图2中两种玻璃的XRD图谱均显示出较宽阔、弥散的衍射峰, 说明水解反应形成的SGBG纳米团粒是非晶态或无定形态固体物质。两种生物活性玻璃的XRD图谱相似, 均属于磷硅酸盐系统, 在网络结构中的Si-O-Si、Si-O-P和P-O-P键的键角均在一定的范围内变动, 不像结晶态物质那样具有固定的键角和晶格间距。这样一种键角的变动导致无定形态物质具有长程无序、短程有序的特殊结构, 从而形成弥散的XRD图谱, 故它们均是以非晶态作为其主要特征。
经测试45S5比表面积较小, 只有3.22 m2/g左右, 而SGBG的比表面积为115.89 m2/g左右, 是45S5的几十倍。这主要是由于SGBG具有特殊的纳米结构所致。在溶胶-凝胶法制备SGBG过程中,TEOS和TEP在催化剂的作用下发生水解、浓缩和聚合反应, 形成球形的、具有[SiO4]和[PO4]顶角相连三维网络结构的纳米溶胶颗粒, 进而通过颗粒间相互链接, 在整个液体中构建成三维多孔的网络骨架[ 13]。作为网络外体的氧化钙引入使得材料的硅氧网络被打断, Ca2+均匀分布在断点周围, 实现局部的电荷平衡。从原子尺度来看, 质点的排列较为松散, 使材料比表面积和活性都得到提高。
氮气吸-脱附曲线研究可揭示材料的多孔性。由图3可以看出, SGBG的吸-脱附等温线, 有明显的滞后环存在, 是典型的中孔多孔材料的吸附类型。而由孔径分布图可以看出, SGBG的孔径分布在5~20 nm范围内, 且具有双峰, 进一步证实了SEM中观察到的二级微球结构。45S5则没有明显的滞后环, 是一种致密的材料。
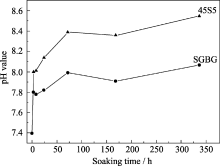
45S5和SGBG的SBF浸泡液在0~336 h时间段(图4), pH值变化趋势基本一致, 在同一时间点45S5大于SGBG。这主要是由于45SS中的Na2O、CaO总体含量比SGBG中高造成的。由于45S5中Na2O和CaO的总体含量比SGBG中的高, 且45S5中含有的Na2O对玻璃网络结构的破坏更加明显, 与SBF接触后会更快的发生离子交换, Na+对pH值的贡献高于Ca2+, 因此45S5 pH值变化比SGBG要大。在两种生物活性玻璃中Na+和Ca2+等阳离子从玻璃网络里溶出, 和OH-发生离子交换在玻璃表面形成硅烷醇, 离子交换将进一步使溶液中的羟基浓度变大, 加速玻璃网络内硅烷醇的形成和玻璃表面的溶解, 随着pH值的逐渐增大, 硅烷醇表面的羟基再次聚合在玻璃表面形成一层富硅层[ 14]。这种pH值及表面结构和化学键的变化对促进创面愈合主要有两方面的作用: (1)局部形成碱性环境, 有效地中和创面的酸性渗出物, 抑止感染; (2)独特的表面活性, 当与软组织接触时, 材料与组织间发生离子交换, 提高局部氧压和pH值, 并在其表面形成负电势而吸附周围的细胞、纤维蛋白及胶原蛋白, 并通过钙、磷层的快速形成稳定这些细胞和蛋白, 从而加速溃疡的愈合[ 15, 16]。但45S5的pH值最大值有8.39, 临床中耐受度低的病人可能会产生疼痛感。因此, SGBG更适宜临床应用。
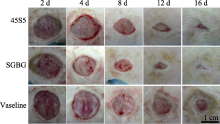
通过创面的大体观察(图5)发现: 2 d时, 各组创面区别不大, BG表面有一层黄白色物质。4 d时, BG组创面缩小, 肉眼可见明显的肉芽组织填充创面。8 d时, BG组创面明显缩小, 肉芽组织已充满创面, 透明上皮层爬移迅速, SGBG组最为明显, 已能覆盖距创缘2~3 mm的新生肉芽组织, 创面颜色开始变淡, 而凡士林组创面也有所缩小。12 d时, BG组创面继续缩小, SGBG组新生的透明上皮组织已完全覆盖创面。16 d时, BG组创面已基本愈合, 而凡士林组仅有少部分愈合。因此, SGBG组的创面愈合效果要好于对照组。
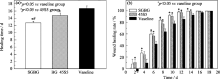
从愈合时间来看(图6(a)), SGBG平均愈合时间为(12.75±0.37) d, 45S5为(14.75±0.65) d, 凡士林组为(16.75±0.65) d, 且生物活性玻璃组与凡士林组相比有显著性差异( P<0.05), SGBG组的创面愈合时间也明显短于45S5组( P<0.05)。从创面愈合率来看(图6(b)), 同一时间点生物活性玻璃组的创面愈合率显著高于凡士林组( P<0.05), 但SGBG和45S5组之间相比无显著差异。
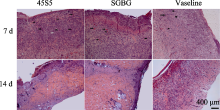
术后7 d, 各组创面均可观察到细胞核呈圆形和类圆形的炎症细胞, 并且有梭形的成纤维细胞(图7)。SGBG和45S5组镜下可见少量炎性细胞, 大量成纤维细胞和丰富的胶原, 毛细血管密集并与创面垂直, 向创面表层生长。凡士林组仍然有大量炎性细胞存在, 也可见成纤维细胞, 但几乎不见新生血管芽。且SGBG 组中, 部分生物活性玻璃颗粒进入创面内部并留下孔道, 并可见更多胶原的沉积。术后14 d, SGBG组最早见上皮完全覆盖创面, 并有丰富的细胞外基质, 其余组上皮还未完全覆盖创面。
创面修复是一个动态、交互的过程, 涉及可溶性调节因子、细胞和细胞外基质。创面修复包括三个相互重叠的阶段, 分别是炎症期、增殖期和重塑期[ 17]。相比正常创面, 由于糖尿病产生的血管病变、神经病变、免疫功能和生物学功能紊乱, 糖尿病创面的愈合要复杂的多, 因此往往难以愈合[ 18, 19]。而肉芽组织的生成与退缩是伤口愈合、组织重建的关键步骤。肉芽组织中含有许多功能活跃的类上皮样细胞和干细胞, 它们具有强大的增殖能力, 对肉芽组织增殖填充伤口具有重要作用[ 20]。根据实验中大体观察和组织切片结果, 可将各组的肉芽组织形成时间作出区分(表1)。可以看出, 相对凡士林组, 生物活性玻璃可以通过促进肉芽组织的生长, 缩短肉芽组织存在的时间, 从而促进了创面的快速愈合。
| 表1 各组创面愈合过程的肉芽组织形成时间(d) Table 1 The stages time of granulation tissue formation in different groups (d) |
1) SGBG和45S5都为无定形态结构。熔融法生物活性玻璃结构致密, 比表面积较小, 因含碱金属的量较高, 所以在SBF中浸泡后其pH值升幅大; 溶胶-凝胶生物活性玻璃SGBG具有二级微球结构, 比表面积较45S5大得多, 在SBF中浸泡一定时间后具有弱碱性, 有利于创面愈合。
2) 生物活性玻璃在促进糖尿病创面愈合方面主要表现为: ①SGBG能较快诱导上皮细胞增殖、分化、移行, 从而形成透明的新生上皮; ②局部形成碱性环境, 可有效中和创面的酸性渗出物, 抑制感染, 利于创面的快速愈合; ③促进肉芽组织生长, 且SGBG组要优于45S5。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|