刘世斌(1963-), 男, 教授. E-mail:sbliu@tyut.edu.cn
通过胶体-化学镀法制备不同厚度薄壳层核壳型Ni/Pt纳米粒子, 采用HRTEM、EDS、XPS和XRD手段对粒子的形貌、晶型和组成进行物理表征. 采用动电位、循环伏安法对其氧电还原和甲醇电氧化活性进行测试. 实验结果表明, 核壳结构Ni/Pt纳米颗粒基本为球形, 其中Ni1-Pt0.067平均直径为7 nm左右, 壳层厚度约1 nm. 与Pt/C相比, 核壳型Ni/Pt纳米粒子对氧电还原和甲醇电氧化的催化活性显著提高. 在所制备的不同壳层厚度催化剂中, Ni1-Pt0.067/C在0.5 mol/L H2SO4中氧电还原的最大峰电流密度可达到143.06 mA/mg, 是相同反应条件Pt/C峰电流密度的1.4倍; 而Ni1-Pt0.067/C在0.5 mol/L H2SO4+1.0 mol/L CH3OH溶液中甲醇电氧化峰电流密度可达538.3 mA/mg, 是Pt/C峰电流密度的5.2倍. 若以1 mg贵金属Pt为基准, Ni1-Pt0.067/C的比质量活性相对Pt/C的提高了30倍.
The Ni/Pt core-shell nanoparticles with different shell thicknesses were prepared by composite coating of colloid particles and then characterized by HRTEM, EDS, XPS and XRD. Electrochemical properties for the oxygen electro-reduction reaction and methanol electro-oxidation were measured by potentiodynamic and cyclic voltammetry. The experimental results show that Ni/Pt core-shell nanoparticles are spherical and the mean particle size of Ni1-Pt0.067 is about 7 nm with shell thickness of 1 nm. Compared with Pt/C, Ni/Pt core-shell nanoparticels possess higher activity. Ni1-Pt0.067/C has the highest catalytic activity in these prepared catalysts with different thickness, and its peak current density can reach 143.06 mA/mg in 0.5 mol/L H2SO4 solution, 1.4 times of that of Pt/C for O2 electro-reduction reaction. Peak current density of Ni1-Pt0.067/C for methanol electro-oxidation reaches 538.3 mA/mg in 0.5 mol/L H2SO4+1.0 mol/L CH3OH solution, which is 5.2 times of that of Pt/C. Based on 1 mg Pt, the specific mass activity of Ni1-Pt0.067/C is 30-fold higher than that of Pt/C nanoparticles.
在纳米电催化领域, 核壳结构双金属纳米粒子具有包覆层金属与核芯金属复合的催化性能, 逐渐成为新型催化剂的研究热点[ 1, 2]. 将Pt包覆在过渡金属外面, 不仅增加贵金属Pt的利用率, 降低催化剂成本, 有效防止过渡金属在酸性等介质中的腐蚀, 还能借助过渡金属核芯对粒子表层Pt产生几何、电子诱导等效应, 从而显著提高催化活性. Shukla等[ 3]与Antolini[ 4]的研究表明, 核壳结构型Pt-M催化剂具有较Pt/C更优异的电催化活性, 如Pt-Co、Pt-Fe催化剂, 氧还原催化活性明显提高, Pt的使用量也大为减少[ 5, 6, 7].
但是, 已有工作存在金属粒子直径较大、壳层厚度较厚的问题, 这对于降低Pt用量, 提高Pt质量比活性, 发挥核芯纳米金属的助催化性能仍嫌不够. 双金属核壳纳米粒子的制备方法主要分为化学还原镀法、欠电位沉积法、胶体粒子模板法等, 但制备直径小于10 nm、壳层厚度小于1 nm的核壳粒子技术仍存在问题, 这也是进一步探索壳层尺寸与催化活性、选择性间基本关系的主要障碍. Lee等[ 8]通过分解羰基化合物前驱体和化学还原法合成核壳型Co/Pt, 粒子的直径约10 nm, 壳层厚度约2 nm, 其活性比Pt/C有明显提高. Yang等[ 9]用两步化学还原镀法合成Aucore-Ptshell催化剂, 平均粒径为25 nm, 壳层厚度约为7 nm, 其催化甲醇氧化的质量活性是Pt的1.52倍. Zhang等[ 10]通过欠电位沉积法制得单层Pt原子的Au-Ni、Pt-Co核壳纳米粒子, 粒子直径分别为15和12 nm, 活性测试发现, 以单位质量贵金属Pt计算的活性比目前商用Pt/C的活性有大幅度的提高, 但是如果以全部金属活性物质量计算的活性并无明显提高.
本工作应用胶体-化学镀法制备粒径更小、壳层厚度更薄的核壳型结构Ni/Pt纳米粒子, 采用电化学法测试催化剂活性, 探究壳层厚度与氧电还原、甲醇电氧化催化活性的关系, 为进一步提升Pt利用率及核壳型Ni/Pt纳米催化剂的研究和开发提供基础.
称取0.0475 g的NiCl2•6H2O和0.2625 g的四辛基溴化铵溶于10 mL四氢呋喃(THF)中, 置于超声波震荡器中分散30 min, 使金属盐完全溶解. 超声条件下将5.5 mL的三乙基硼氢化锂滴加于上述溶液中, 超声反应30 min, 得到黑色的镍纳米胶体. 按照 nNi/ nPt=15的比例, 将0.0035 g的PtCl2溶于 10 mL的四氢呋喃(THF)中, 超声条件下将PtCl2溶液缓慢地滴加至上述胶体中, 超声反应60 min, 即得到Ni1-Pt0.067胶体. 样品置于高速离心机进行液固分离, 离心机转速5000 r/min, 固液分层后去掉上清液, 再次加入四氢呋喃分散洗涤, 如此用四氢呋喃、乙醇各反复洗涤三次. 最后, 固体样品在80℃真空箱中干燥12 h, 管式炉氩气气氛中400℃热处理1 h, 即可获得黑色核壳型Ni1-Pt0.067纳米粒子样品. (不同原子比的核壳型Ni/Pt纳米粒子可通过改变Pt前驱体的加入量来获得).
实验装置为三电极体系, 其中工作电极为旋转圆盘玻碳电极, 使用前电极表面用Al2O3悬浮液充分擦拭, 然后分别在丙酮和Millipore超纯水中各超声洗涤3次, 以除去电极表面的油污及其它杂质. 称取2 mg的制备好的Ni/Pt纳米粒子、3 mg的XC-72炭黑(含碳60wt%)与5 mL超纯水混合, 超声均化至均匀分散. 用移液管移取6.0 μL悬浮液涂于干净的玻碳电极表面, 50℃下烘干; 移取7.2 μL浓度为0.2750 g/L的Nafion(5wt%)溶液, 涂于催化剂薄层上, 90℃烘干, 即得到电化学实验薄膜电极.
采用FEI公司(原PHILIPS)产的Tecnai G2 F20场发射透射电子显微镜(HRTEM)表征核壳纳米粒子微观形貌, 加速电压为200 kV. 采用XRD表征粒子的晶相结构, 仪器型号为D/max-2500, 日本Rigaku公司, 辐射源为CuKα( λ=0.154056 nm), 管电压40 kV, 管电流30 mA, 扫描速度: 8°/min, 2 θ扫描范围: 5°~85°. 采用美国LEO438VP型X射线能谱分析(EDS)测定元素组成及元素比例. 电子束电流密度为40 A/cm2, 加速电压100 kV. 采用VG Scientific ESCALab 250i-XL型X射线光电子能谱仪(XPS)测定催化剂的表面元素组成及其价态, 激发源为Al Kα X射线, 功率约300 W, 扫描步长为 0.05 eV.
电化学测试仪器为美国PAR公司产的VMP2型多通道恒电位仪及AFMSRXE-536型旋转圆盘电极. 催化剂活性分别采用动电位扫描和循环伏安法表征. 实验装置为三电极体系, 旋转圆盘体系为工作电极, Pt丝环为对电极, Hg/Hg2SO4(MSE)为参比电极. 电解液为0.5 mol/L硫酸+ x mol/L甲醇(其中, x=0和1.0). 动电位测试前通氧气30 min, 使电解液中溶解氧达到饱和, 实验中继续通适量氧气保持氧浓度, 扫描速度为10 mV/s, 旋转圆盘电极转速为 r=2000 r/min. 循环伏安测试时以圆盘电极为工作电极(转速为0), 扫描速率为50 mV/s, 测试前向电解液中通入高纯氮气30 min, 以除去其中的氧. 所有实验均在(25±1)℃下进行, 文中电极电位数值均相对于Hg/Hg2SO4参比电极.
2.1.1 催化剂的物理表征
图1为Ni1-Pt0.067纳米粒子的TEM照片, 由图可见, 金属纳米粒子基本是球形, 粒径较为均匀, 约为7 nm. 图1出现的个别较大颗粒, 可能是由于磁性纳米镍造成核壳粒子团聚. 由图1插图可明显看出, 颜色较深的部分为Ni核, 晶格条纹明显, 直径大约为5 nm, 以不规则形状包围在核周围、颜色较浅的部分为壳层, 壳层的厚度不足1 nm, 这说明通过胶体-化学镀法能够使Pt包覆在纳米Ni表面形成核壳结构Ni/Pt纳米粒子. Ni1-Pt0.1和Ni1-Pt0.05纳米粒子的壳层厚度约为1.3和0.8 nm.
 | 图1 Ni1-Pt0.067纳米粒子的TEM和HRTEM照片Fig. 1 TEM image of Ni1-Pt0.067nanoparticlesInset is HRTEM image of a single core-shell nanoparticle |
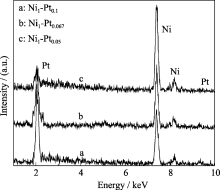
图2是核壳型纳米粒子Ni1-Pt0.1、Ni1-Pt0.067和Ni1-Pt0.05的EDS图谱, 从图中可看出, 三个样品均只含有Pt、Ni两种元素, 未出现其它元素. 随着Pt与Ni前驱体摩尔比的减小, 金属粒子中Pt的原子比逐渐减小, Ni的原子比逐渐增大. 测得的三个样品的Ni与Pt的原子比均与理论的投料比相一致, 结合制备方法和EDS表征手段的特性可以进一步推断所制得的样品为核壳结构.
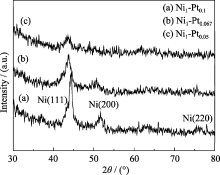
图3是核壳型Ni/Pt纳米粒子的XRD图谱. 可以看出, 在44.3°、51.7°和76.4°处存在衍射峰, 分别对应于面心立方(fcc)Ni(111)、(200)和(220)晶面的衍射峰, 其中Ni(111)晶面衍射峰的强度较大, 其它衍射峰强度都相对较弱. 图谱中没有出现块状Pt的衍射峰, 这是由于形成的核壳纳米粒子的壳层很薄, 而且Pt原子层数少排列不规则未能形成晶体. 随着合成过程中Pt、Ni前驱体摩尔比的减小, Ni(111)晶面的衍射峰降低, 半峰宽变宽. 说明在纳米粒子Ni的表面存在Pt, 影响了衍射峰强度.
相对于纯Ni, 核壳型Ni/Pt纳米粒子Ni各个晶面的衍射峰都有微小的负移, 并且壳层厚度越小负移的程度越大, 峰形变秃, 这是由于壳层Pt对核芯Ni产生电子诱导效应, Pt的 d电子进入Ni的 d轨道, 而Ni相对较多的 s电子反馈至Pt的 s轨道, 总的结果是Pt原子显示负电性, Ni原子则显示正电性, Ni金属核芯出现晶格膨胀. 至于壳层厚度越小这种效应越显著则可能与金属粒子表面Pt原子排列不紧密有关, 由于Pt原子彼此间距大于块状金属Pt原子的间距, 原子间以及对Ni核芯都可能产生较大的吸引力, 壳层越薄, 这种力越强, 以至于Ni核芯的晶格扭曲变形, 其衍射峰的峰形变秃. 有关原因还需进一步深入研究. 以上表征结果都显示, 本研究所制备的样品是Pt包覆面心立方晶系Ni形成核壳结构Ni/Pt纳米粒子. 利用Scherrer公式和Ni(200)晶面衍射峰的半峰宽可计算出Ni1-Pt0.1、Ni1-Pt0.067和Ni1-Pt0.05的Ni核的直径, 分别为5.7、5.5、5.4 nm, 与TEM照片中粒子尺度大小相吻合.
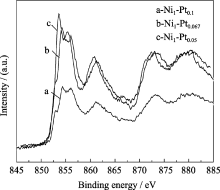
图4中的a、b、c分别为Ni1-Pt0.1、Ni1-Pt0.067和Ni1-Pt0.05纳米粒子的Ni2p XPS图谱. 从图中可以看出, 在855、861、872、878eV位置存在四个Ni2p的结合能峰, 谱线的强弱顺序为Ni1-Pt0.05 > Ni1-Pt0.067> Ni1-Pt0.1. 由此可以看出, 随着反应物Pt原子比的增加, Ni能谱峰强度减小, 说明表面物种阻碍X射线的能力增强, 即壳层厚度增加, 使Ni2p的结合能峰值降低. 图中核壳型纳米粒子中仍然存在Ni2p峰, 是由于所形成的壳层厚度很薄(低于2~4nm), X射线透过壳层给出了亚表层的Ni2p峰.
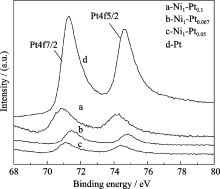
图5中的a、b、c分别为Ni1-Pt0.1、Ni1-Pt0.067、 Ni1-Pt0.05和Pt纳米粒子的Pt4f XPS谱图. 从图中可以看出, 在71.0 eV和74.3 eV位置存在两个Pt4f的结合能峰, 谱线强度的顺序为: Pt > Ni1-Pt0.1 > Ni1-Pt0.067 > Ni1-Pt0.05. 由此可以看出, 随着Pt沉积厚度的增加, Pt4f结合能峰的峰值提高, 纯纳米Pt的峰值达到最大. 这种现象与图4的结果相互印证, 进一步表明了Ni1-Pt0.1、Ni1-Pt0.067和Ni1-Pt0.05纳米粒子呈核壳结构, 且壳层厚度呈减小的趋势.
图6为不同催化剂的XPS图谱及其分峰结果曲线, 表1是Pt4f电子结合能及Pt元素不同价态原子的比例. 可以看出, 三个样品的表面Pt0、Pt2+原子比相当, 明显比纯Pt纳米粒子的大得多. 这是因为很少量的Pt包覆在较大的Ni核芯表面, 使Pt壳层的电子态密度增大, 表面的Pt0原子比相对于纯Pt纳米粒子的Pt0原子比高一些, 而Pt2+的原子比低一些. 另外还可以发现, XPS测得的Ni/Pt原子比明显低于EDS测得的Ni/Pt原子比, 依据两种测试方法的原理可知, 由于粒径较小, EDS测得的Ni和Pt的原子比可能是整个纳米粒子原子比的平均值, 而XPS测得的Ni/Pt原子比是粒子近表层(深度约为2 nm~ 4 nm)的原子比, 两组数据的差距表明核壳型粒子表面具有较高的Pt原子比, 这也从另一个侧面说明, 所得样品是核壳型纳米粒子.
| 表1 不同催化剂Pt4f的电子结合能与表面Ni和Pt原子比 Table 1 Binding energies and atomic ratio of Ni and Pt on different catalysts surface |
2.1.2 催化剂的电化学表征
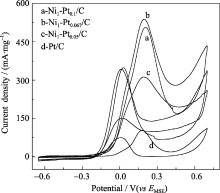
图7为Pt/C、Ni1-Pt0.1/C、Ni1-Pt0.067/C和Ni1- Pt0.05/C在氮吹脱的0.5 mol/L H2SO4电解液中的循环伏安图. 氮气吹脱后电解液中氧的浓度很低, 可以认为是零. 可以看到, 三种催化剂的循环伏安曲线与纯Pt纳米粒子的曲线非常相似, 在-0.7~-0.4 V电位范围内的氧化峰、还原峰分别对应吸附氢的氧化峰和析氢峰; 在-0.2 V~0.2 V范围的还原峰对应Pt表面含氧物种的还原峰, 在大于0 V范围一个氧化峰对应Pt表面氧的吸附峰. 另外, 在图7中并没有观察到Ni粒子的溶解氧化峰, 说明制备的纳米粒子表面为Pt, 并且对内部核芯元素起到很好的保护作用.
从图7(b)中可以看出, 在-0.7~ -0.4 V范围内的氢脱附峰面积大小依次为Ni1-Pt0.05/C > Ni1-Pt0.067/C > Pt/C > Ni1-Pt0.1/C. 根据氢的脱附峰部分的面积, 积分计算出氢的脱附峰面积 Qd, 进而可计算出催化剂的电化学活性比表面积, 数据列于表2中. 可以看到, 金属粒子中Pt原子比越小, 吸附氢的电化学比表面积越大, 粒径的差异是其重要原因之一, 但鉴于纳米粒子直径的不同导致的粒子比表面的差异小于电化学比表面积的差异, 可以判断, 引起电化学比表面积差异的另一重要原因可能与表面电子态有关, Ni1-Pt0.05/C中Ni原子比相对较大, 金属粒子表面电子态密度较大, 而且Pt壳层向Ni核芯偏转的d电子比率较高, 其孤电子d轨道和空的d轨道的比率也相对较高, 为提高吸附氢的活性位密度提供了较大作用, 从而使电化学比表面积 Aec的增幅较大.
| 表2 Pt/C和Ni/Pt催化剂的电化学表征 Table 2 Electrochemical characterization of Pt/C and Ni/Pt catalysts |
2.2.1 壳层厚度对核壳型Ni/Pt纳米粒子氧电还原催化活性的影响
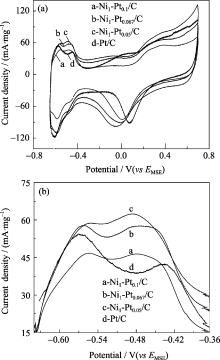
图8是Pt/C及Ni与Pt原子比为1:0.1、1:0.067、1:0.05的纳米粒子在氧饱和的0.5 mol/L H2SO4电解液中的动电位扫描曲线, 由图可见, Pt/C的氧还原起始电位为0.25 V, Ni/Pt催化剂的起始电位按Pt与Ni原子比由大到小次序依次为: 0.26、0.29、0.28 V; Pt/C氧还原的最大峰电流密度为102.4 mA/mg, Ni/Pt纳米粒子的最大峰电流密度按Pt与Ni原子比由大到小次序依次为: 115.7、143.06、126.62 mA/mg. 随着壳层厚度的减小, 催化剂的电催化活性呈先增大后减小, 其中Ni1-Pt0.067/C的催化活性最高.
 | 图8 Pt/C和Ni/Pt催化剂在0.5 mol/L硫酸中动电位图Fig. 8 Potentiodynamic of Pt/C and Ni/Pt catalysts in 0.5mol/L H2SO4 |
图9是以1 mg Pt为基准计算的核壳结构Ni/Pt纳米粒子的比质量活性, 由图可以看出, 电位为-0.58 V时, Pt/C氧还原的电流密度仅为110 mA/mg, 而核壳型Ni/Pt纳米粒子的电流密度按Pt与Ni原子比由大到小次序依次为: 460、791、892 mA/mg, 相对于Pt/C的电流分别提高了3.18、6.19和7.11倍, Ni1-Pt0.05/C在各催化剂中相对活性最高. 这一结果说明, Pt与Ni形成的核壳纳米粒子催化效率有明显提高.
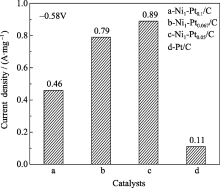 | 图9 Pt/C和Ni/Pt催化剂在0.5 mol/L硫酸中以1 mg Pt为基准的比质量活性柱状图Fig. 9 Specific mass activity histogram of Pt/C and Ni/Pt catalysts based on 1 mg Pt in 0.5 mol/L H2SO4solution |
2.2.2 壳层厚度对核壳型Ni/Pt纳米粒子催化甲醇电氧化活性的影响
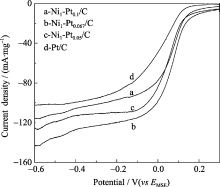
图10是Pt/C及Ni/Pt纳米粒子在氮吹脱的 0.5 mol/L H2SO4+1.0 mol/L CH3OH电解液中的循环伏安曲线, 由图可见, 在无氧的情况下, Ni/Pt纳米粒子上甲醇氧化电流密度的变化形式与Pt/C的相似, 在电位正向扫描时, Pt/C上甲醇氧化峰电流密度为102.9 mA/mg, 而依Pt与Ni原子比由大到小的顺序, Ni/Pt纳米粒子的峰电流密度分别为508.19、538.3、312.69 mA/mg, 其中Ni1-Pt0.067/C的氧化峰电流密度为Pt/C的5.2倍. 这一结果表明, 随着壳层厚度的减小, 核壳型Ni/Pt纳米粒子催化氧化甲醇的活性呈先增大后减少的趋势.
 | 图10 Pt/C和Ni/Pt催化剂在0.5 mol/L 硫酸+1.0 mol/L甲醇中的循环伏安图Fig. 10 Cyclic voltammograms of Pt/C and Ni/Pt catalysts in 0.5 mol/L H2SO4+1.0 mol/L CH3OH solution |
图11是以1 mg Pt为基准计算的核壳型Ni/Pt纳米粒子在不同电极电位下的比质量活性, 由图可以看出, 电压为-0.01和-0.16 V时, Pt/C甲醇氧化电流密度仅为17和94 mA/mg, 而Ni1-Pt0.067/C甲醇氧化电流分别为990 和2820 mA/mg. 在-0.16 V时, Ni1-Pt0.067/C相对于Pt/C的比质量活性提高了30倍, 在各催化剂中相对活性最高.
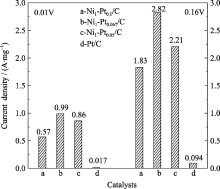 | 图11 Pt/C和Ni/Pt催化剂在0.5 mol/L硫酸+1.0 mol/L甲醇中以1 mg Pt为基准的比质量活性柱状图Fig. 11 Specific mass activity histogram of Pt/C and Ni/Pt catalysts based on 1 mg Pt in 0.5 mol/L H2SO4+1.0 mol/L CH3OH solution |
相对于Pt/C, 核壳型Ni/Pt纳米粒子对氧电还原、甲醇电氧化的电催化活性都有明显提高. 对于前者, 其原因主要是, Pt原子和Ni原子之间电子的偏转(成键d电子数较高的Pt原子向Ni原子转移部分成键d电子, 而低电负性Ni原子向Pt原子偏转部分s电子, 相对而言, Pt原子核周围集中了较多的电子, Pt原子略显负电性), Pt壳层的费米能级附近电子密度变小, 5d轨道的空缺率增加, 使得O2分子易于与Pt原子空的悬空d轨道形成单臂或桥式吸附, 这种较强的相互作用可有效减弱O=O键, 甚至引起O2的解离吸附[ 1], 从而提高其ORR催化活性. 对于甲醇电氧化活性提高的原因, 作者认为, 金属粒子表面较大密度的空的悬空d轨道以更大的几率与C-H的 σ键形成配位键, 同时具有孤对电子的d轨道与C-H的反键 σ*轨道重叠, 将d电子反馈与 σ*轨道, 促进C-H键断裂, 从而提高了甲醇分子的吸附、脱氢活性. 另外, 较大密度的空的悬空d轨道也十分有利于H2O的脱氢生成OHads, 这两方面都会促进甲醇的电氧化. 值得注意的是, 金属粒子壳层Pt原子间排列较疏松, Pt原子间距大, 对甲醇分子吸附的空间位阻小, 非常有利于空d轨道与C-H的 σ键形成配位键, 这一点也是导致核壳结构Ni/Pt纳米粒子催化活性提高的重要原因. 不过, Pt壳层的厚度(或元素比例)应适宜, 并非Pt加入比例越高或越低越好. 当原子比明显超过或低于适宜值时, Pt壳层的5d空轨道的缺电子性质过强或不足, Pt原子的d电子对 σ*、2 π*轨道的反馈变难, 导致核壳结构Ni/Pt纳米粒子的催化活性提高不显著.
采用胶体-化学镀法制备了不同壳层厚度的薄壳层核壳结构Ni/Pt纳米粒子, 其中Ni1-Pt0.067平均直径约为7 nm, 壳层厚度约1 nm. Nicore-Ptshell/C相对于Pt/C催化剂, 氧电还原和甲醇电氧化催化活性显著提高, Pt利用率大幅提升, 但壳层厚度并非越薄越有利, 其活性随壳层厚度的减小呈先增大后减小.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|