李 丽(1986-), 女, 硕士研究生. 通讯作者: 嵇天浩, 教授. E-mail:jitianhao@th.btbu.edu.cn
采用Cu2O自牺牲模板法, 以负载有立方相p-型半导体Cu2O颗粒的TiO2纳米带作为前驱物, 在水热条件下与硫脲进行反应, 制得了负载有立方相p-型半导体Cu1.8S颗粒的TiO2纳米带. 测试结果表明, 反应温度、反应时间和硫脲浓度对Cu1.8S纯度和形貌皆有影响. 若反应在较低温度(如120℃)进行, 即使反应时间达到25 h, 产物中除了生成Cu1.8S还存在未反应Cu2O; 若水热温度控制在160℃反应25 h, 当硫脲浓度为0.25 mol/L时, 负载物基本上是Cu1.8S且分散较好, 当硫脲浓度升到0.5 mol/L时, 负载物团聚严重. 对罗丹明B的光催化降解活性测试结果表明, 与纯TiO2纳米带相比, 在负载有Cu2O或Cu1.8S后光催化活性显著降低.
TiO2 nanobelts deposited with cubic p-type semiconductor Cu1.8S particles were prepared using Cu2O-deposited TiO2 nanobelts and thiourea as precursors under hydrothermal condition by Cu2O sacrificial template process. The measurement results show that the reaction temperature, reaction time and thiourea concentration have strong influence on the purity and morphology of Cu1.8S particles. A mixture phases of Cu1.8S and Cu2O on TiO2 nanobelts were obtained at 120℃ for 25 h within 0.5 mol/L of thiourea concentration. While reaction temperature was raised to 160℃, the Cu1.8S particles with high purity exhibited obvious aggregation, whereas the Cu1.8S particles with high purity and well dispersion were prepared under 0.25 mol/L of thiourea concentration. The photocatalytic activities in degradation of Rhodamine B solution demonstrate that the Cu1.8S or Cu2O-loading catalysts show lower photodegradation activities as compared with that of pure TiO2 nanobelts.
作为最重要的半导体氧化物之一, TiO2已广泛应用于各种领域, 其中, TiO2纳米管或纳米带因在光催化、光电转换或纳米器件上具有TiO2纳米粒子无可比拟的优点而受到特别关注[ 1, 2, 3, 4, 5]. TiO2纳米带可以在强碱溶液中水热条件下大量制备并应用[ 6], 但为了提高其可见光利用率, 需要进行改性, 如金属离子掺杂[ 7]或半导体负载[ 8, 9]等. 禁带宽度处在可见光区域的半导体颗粒如CdS(或/和ZnS)[ 8]或BiVO4[ 9]的负载, 是提高TiO2 NBs可见光利用率和光催化活性的有效方法. 然而, 具有可见光吸收的p-型半导体负载影响机理目前尚不清楚.
立方相Cu1.8S是富铜相Cu xS( x≠1)中的一种. 富铜相Cu xS作为p-型半导体材料, 在太阳能电池或光催化等领域有潜在应用价值[ 10, 11, 12, 13]. 通常这种材料在室温下主要有四种结构: 辉铜矿(Cu2S)、蓝辉铜矿(Cu1.8S)、久辉铜矿(Cu1.93S)和斜方蓝辉铜矿(Cu1.75S), 它们都具有光伏性能, 其中蓝辉铜矿Cu1.8S是一种间隙p-型半导体[ 14, 15], 可通过Cu2O颗粒自牺牲模板法制得. 例如, Qian等[ 16]采用自牺牲模板在90℃下制备了十八面体Cu7S4纳米笼; Xu等[ 17]使用八面体Cu2O在90℃下与硫脲进行反应制备了八面体CuS纳米笼; Zhang等[ 18]使用Cu2O纳米球在室温下与Na2S溶液反应制得了立方相Cu1.8S中空纳米球, 在空气中放置8 h后又被氧化成六方相CuS中空纳米球. 本工作采用Cu2O自牺牲模板法制备了负载有立方相Cu1.8S的TiO2 NBs复合半导体.
按照文献[ 19]所述的两步水热制备过程, 首先由具有层状结构的钛酸盐纳米带通过相转化制得锐钛矿型TiO2纳米带(NBs). 负载有Cu2O颗粒的TiO2 NBs(Cu2O-TiO2 NBs)复合材料的制备过程如下: 在室温下, 100 mL 0.25 mol/L [Cu(NH3)4]Cl2水溶液与10 g TiO2 NBs混合, 搅拌一段时间后过滤, 用去离子水洗涤至中性, 再将过滤物放置于100 mL水中, 在缓慢搅拌下滴加入10 mL 2.5wt%的水合肼溶液, 滴加完后过滤洗涤即可获得前驱物Cu2O-TiO2 NBs. 取3 g Cu2O-TiO2 NBs置于50 mL反应釜中, 注入25 mL 0.25 mol/L或0.50 mol/L的硫脲溶液, 于 160℃反应不同时间后自然冷却至室温, 过滤洗涤, 制得负载有立方相Cu1.8S颗粒的TiO2 NBs. 具体制备条件见表1.
| 表1 负载有立方相Cu1.8S的TiO2纳米带复合材料的制备条件 Table 1 Preparation condition of the cubic Cu1.8S-loaded TiO2 nanobelts |
通过XRD(Shimadzu XRD-6000, CuKα), Raman (PE Flex-400), SEM(JEOL-JSM 6490), TEM和HRTEM (JEOL-JSM 2010), UV-Vis(Shimadzu UV-3600), BET (Mcromerities ASAP2020)对样品进行表征.
在自制光催化反应器上测定样品的可见光催化活性, 以罗丹明B分子作为探针评价样品的光催化降解活性. 室温下, 称取100 mg 光催化剂, 快速加入到150 mL 7 μmol/L罗丹明B溶液中, 黑暗下搅拌30 min, 使罗丹明B分子在样品表面的吸附与脱附达到平衡. 开启300 W钨灯照射光催化系统(钨灯与溶液的距离为20 cm), 其中混合液处在搅拌状态以保证反应液浓度的均匀性. 每隔一段时间取6 mL混合液, 经离心分离后取上层清液在UNICO-2000可见光分光光度计上测定其在555 nm的吸光度值, 用紫外-可见分光光度计(VARIAN CARY-50)进行紫外可见全扫描, 根据吸光度值变化确定催化体系中罗丹明B的降解程度.
在水热条件下, 通过Cu2O-TiO2 NBs中Cu2O与硫脲中硫的反应, 就可制得负载有蓝辉铜矿立方面心结构Cu7.2S4(立方相Cu1.8S)颗粒的TiO2 NBs复合半导体材料. 由于硫脲易发生互变异构成为烯醇式异硫脲, 而异硫脲化学性质较活泼, 是硫脲的主要反应形式, 因此, 在反应时硫脲不仅提供硫源, 而且是弱还原剂, 在一定程度上可阻止Cu1.8S氧化并抑制CuS生成.
图1是表1中七个产物的XRD图谱. 前驱物Cu2O-TiO2 NBs的XRD数据作为对比. 由图1(a)可清楚观察到, 立方相Cu2O的(110)、(111)和(200)晶面衍射峰(JCPDS 05-0667), 然而经160℃硫脲溶液水热处理后, 上述衍射峰基本消失, 而在2 θ为27.7°、32.2°和46.1°处出现新衍射峰, 分别与立方相Cu1.8S(JCPDS 24-0061)的(111)、(200)和(220)晶面对应, 2 θ=29.2°处的衍射峰可能与少量未反应的Cu2O有关(如图1中箭头所示). 随着反应时间延长, 例如CT-3, 这些衍射峰强度也明显增强, 说明反应时间延长有助于生成更多更大的Cu1.8S; 反应时间相同,增大硫脲浓度(从0.25 mol/L增到0.5 mol/L)对负载物Cu1.8S的生成影响不大, 但在0.5 mol/L硫脲溶液中反应25 h后所制得的产物CT-7中有未知相存在(见图1B(g)在2 θ=43.7o处的衍射峰); 若反应体系处在0.5 mol/L硫脲浓度中于120℃下进行反应, 即便反应25 h(CT-4), 产物中Cu1.8S的量也不多.
 | 图1 Cu2O-TiO2纳米带(a)、CT-1 (b)、CT-2 (c)、CT-3 (d)、CT-5 (e)、CT-6 (f)和CT-7 (g)的XRD图谱Fig. 1 XRD patterns of Cu2O-TiO2 nanobelts (a), CT-1 (b), CT-2 (c), CT-3 (d), CT-5 (e), CT-6 (f) and CT-7(g) |
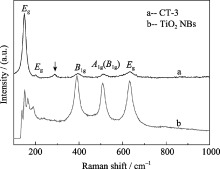
使用显微拉曼散射技术在100~1000 cm-1范围内对CT-3做了进一步测试, 如图2所示. 在150、394、511和633 cm-1左右的四个峰分别归属为锐钛矿型TiO2的 Eg、 B1g、 A1g + B1g和 Eg特征光子模[ 20], 其中, 前两个低频峰是由O-Ti-O弯曲振动引起的, 而后两个峰则是由Ti-O伸缩振动产生的. 在 288 cm-1处的拉曼峰是由负载的立方相Cu1.8S产生的新峰(如箭头所示), 与在文献[ 21]中用电化学技术在Na2S溶液中使Cu2O薄膜转化为Cu1.8S的拉曼光谱结果相似.
为了进一步观察产物中立方相Cu1.8S的形貌和负载情况及元素构成, 对产物进行了SEM和TEM及EDS测试. 图3是产物CT-3、CT-4和CT-7的SEM照片(插图为相应样品的EDS分析)及CT-3的TEM照片, 前驱物Cu2O-TiO2 NBs的SEM照片作为对比. 前驱物Cu2O-TiO2 NBs的制备条件、Cu2O负载情况和光催化性能已详细研究, 照片中负载在TiO2 NBs表面的颗粒是立方相单晶Cu2O, 粒径处在200~ 400 nm间(图3(a)). 用硫脲水热处理获得的CT-3, 生成的Cu1.8S负载物颗粒普遍变小, 粒径主要处在80~200 nm间, 分布较宽且不规则(图3(b)和(e)), 这是因为生成Cu1.8S需经过Cu2O原位自牺牲反应, 再生长后才能获得负载物Cu1.8S颗粒. EDS测试结果表明, Cu原子数约是S的两倍, 支持产物Cu1.8S的组成. 若反应温度和时间不变, 将硫脲浓度提高一倍, 则产物CT-7中负载物团聚严重(图3(d)), 这可能与硫脲中S与Cu2O反应更快有关. 然而, 若其它反应条件和制备过程与CT-7完全相同, 只是反应温度降低到120℃(CT-4), 则负载物很少发生团聚(图3(c)), 依前面XRD测试可知, 它们中只有一部分转变为Cu1.8S, 由反应过程推测, 这部分产物可能包覆在Cu2O颗粒表面, 在插图中EDS的Cu与S原子比值1.7就包括Cu2O中Cu原子的贡献, 而S原子来自于生成的Cu1.8S和吸附的硫脲分子. 由CT-3的HRTEM照片(图3(f))可清晰观察到相邻晶面间距为0.277 nm的条纹相, 对应于(200)晶面, 与此晶面垂直的方向是[200]方向. 此照片也证实在CT-3中存在粒径很小的Cu1.8S纳米粒子.
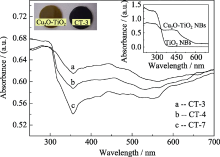
图4是样品CT-3、CT-4和CT-7的紫外-可见漫反射光谱(UV-Vis DRS), 由图可知, 产物光吸收主要由三部分构成: 低于波长360 nm的吸收、处于 360~550 nm间的吸收和高于550 nm的吸收. 通过与Cu2O-TiO2纳米带吸收对比可知, 前一部分吸收主要由产物中TiO2纳米带产生, 中间部分则可能来自于Cu2O或/和Cu1.8S, 因为它们都是p-型半导体材料, 块材的禁带宽度分别为2.17 eV(波长571 nm)和2.35 eV(波长528 nm), 处在相近的吸收区域内, 难于区分; 而后一部分吸收较复杂, 可能是由于Cu1.8S的部分氧化或者其Cu与S计量比向Cu2S(禁带宽度约为1.2 eV)靠近而导致的.
图5是Cu2O-TiO2 NBs CT-3、CT-4和CT-7的N2吸附/脱附曲线, 由图可知, 四个样品的N2吸附/脱附回线主要处在0.6~1.0 P/ P0范围内, 回滞环不明显, 说明它们是无孔材料, 主要是纳米带和Cu1.8S晶粒都较大, 它们堆积形成的大孔用N2等温吸附法已很难测定. 用BET法计算Cu2O-TiO2 NBs、CT-3、CT-4和CT-7的吸附/脱附曲线得出其比表面积分别为49.2、36.6、42.2和42.8 m2/g, 它们远小于TiO2纳米带的比表面积(84.9 m2/g). 由此分析, 负载后复合材料比表面积降低可能主要与因负载而导致TiO2 NBs光滑度提高有关, 由钛酸盐纳米带经过相转变制得TiO2 NBs后表面并不光滑, 而在负载后部分覆盖了有些粗糙的TiO2 NBs表面; 另外, 负载物颗粒的粒径分布对比表面积降低也有影响. 不过对于负载后的样品的比表面积变化并不大.
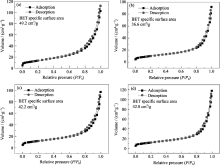 | 图5 (a) Cu2O-TiO2纳米带; (b) CT-3; (c) CT-4; (d) CT-7产物的N2吸附/脱附曲线Fig. 5 N2 adsorption/desorption isotherms of (a) Cu2O-TiO2 nanobelts; (b) CT-3; (c) CT-4; (d) CT-7 |
在相同实验条件下, 纯TiO2 NBs、Cu2O-TiO2纳米带、CT-3、CT-4和CT-7对罗丹明B的可见光光催化降解活性如图6所示, 由图可知, 在光照3 h后, 纯TiO2 NBs的光降解活性最高, 其次是样品CT-3和CT-7, 而样品CT-4和前驱物Cu2O-TiO2纳米带的最低. 对于复合半导体材料, 影响光催化降解活性的因素很复杂, 除了与照射光本性有关外, 还与复合材料本性、比表面积、形貌及复合情况有很大关系.
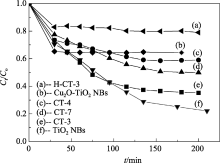 | 图6 H-CT-3、CT-3、CT-4和CT-7对罗丹明B的可见光光催化降解活性Fig. 6 Visible-light photodegradation of Rhodamine B on H-CT-3, CT-3, CT-4 and CT-7H-CT-3 is made from CT-3 dipping in dilute HCl solution for short time |
由于钨灯光线中含有少量紫外线, 能够激发TiO2价带上的电子, 进而使其具有光催化作用, 因而纯TiO2纳米带显示出高光降解活性. 由于Cu2O和TiO2分别是p-型和n-型半导体材料, 并且Cu2O负载部分覆盖了TiO2表面, 在Cu2O-TiO2 NBs中电子很难从Cu2O向TiO2转移, 因此此样品几乎没有光催化活性. 但是在120℃或160℃下用硫脲处理后制得的样品CT-3、CT-4和CT-7则具有光催化活性, 这三种产物的比表面积与Cu2O-TiO2纳米带相比较变化不明显, 可见它们的光催化活性差异与比表面积关系不大, 而可能与生成Cu1.8S的多少及其粒径大小有关. 立方相Cu1.8S块材也是典型的p-型半导体材料, 当它们负载在n-型半导体TiO2 NBs表面后形成了p-n异质结, 在可见光照射下, 电子很难从Cu1.8S上转移到TiO2表面, 这一点也可由它们能级不相配得到证明[ 22], 因而导致光催化活性低于纯TiO2纳米带. 若Cu1.8S的粒径变小, p-型半导体性质不明显, 则其光催化活性有可能较高. 由于样品CT-3、CT-4和CT-7的制备经过Cu2O与硫脲反应过程, 生成的Cu1.8S粒径范围可能较宽, 其中少量粒径非常小的Cu1.8S在吸光后将电子传递给TiO2并产生光催化作用, 但因比表面积较低(例如CT-3), 光催化活性仍低于纯TiO2 NBs. 不同实验条件直接影响着能够传递电子的Cu1.8S负载量, 若反应温度过低(如CT-4), 部分生成的Cu1.8S可能大部分处在Cu2O表面, 光催化活性就会很低; 若硫脲浓度较高, 反应过快, 生成的Cu1.8S发生团聚(如CT-7), 直接负载在TiO2上的小粒径Cu1.8S量减少, 光催化活性也会降低. 为了验证此推断, 用稀盐酸对CT-3进行了短时间浸泡制得了H-CT-3, 以便能够溶掉小粒径Cu1.8S, 实验结果表明, 此样品如同Cu2O-TiO2 NBs一样几乎没有光催化活性.
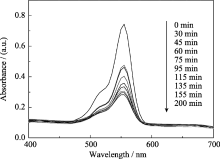
从对罗丹明B的吸收光谱中更能够直观地观察到CT-3的降解程度(图7). 罗丹明B的特征吸收峰位于555 nm处, 因此, 通过对在不同反应时间下555 nm处吸收峰强度的变化就可以推断出罗丹明B含量的变化. 由此图可知, 随着反应时间延长, 吸收峰逐渐减弱, 且变化较显著, 说明CT-3的光催化活性较高.
以立方相Cu2O负载的TiO2纳米带和硫脲作为前驱物, 在水热条件下制得了蓝辉铜矿面心立方结构Cu1.8S负载的TiO2纳米带. 负载物纯度和形貌与反应温度和时间及硫脲溶液浓度有很大关系. 反应温度较低或反应时间过短都不利于Cu1.8S的完全生成; 硫脲溶液浓度过高, 反应过快, 也不利于Cu1.8S的负载, 并将导致Cu1.8S粒子发生严重团聚. 由于Cu1.8S的负载降低了纯TiO2纳米带表面的粗糙度, 致使比表面积明显下降. 通过对罗丹明B的光催化活性测试结果表明, 与纯TiO2纳米带相比, 无论是前驱物Cu2O负载的TiO2纳米带还是Cu1.8S负载的产物, 光催化活性皆降低.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|