王岳俊(1983-), 男, 博士研究生. E-mail:thirtythree61@yahoo.com.cn
在不加任何添加剂和高反应物浓度的条件下, 用CuSO4、NaOH、葡萄糖为原料制备了Cu2O球形粉体. 利用扫描电镜和smileview软件对Cu2O粉体进行了表征分析, 主要考察了加料方式对Cu2O颗料的分散性与粒度稳定性的影响, 并根据Lamer模型初步探讨了其影响机理. 结果表明, 当采用先将NaOH溶液与CuSO4溶液分步缓慢混合制备Cu(OH)2作为铜源, 再加入葡萄糖还原Cu(OH)2制备Cu2O的加料方式时, Cu2O颗粒按“爆发成核, 缓慢生长”的模式形成, 制得的Cu2O粉体分散性高, 粒度稳定性好. 分散性高是由于缓慢的晶核生长有利于通过搅拌作用使初始晶核间的软团聚体再分散, 避免软团聚体进一步通过化学键合发展成为硬团聚. 粒度稳定性好的原因是将NaOH溶液分步缓慢加入到CuSO4溶液中制备的前驱体Cu(OH)2热稳定性好, 较好地保持了前驱体升温过程中铜源组分的单一性, 避免了还原过程中出现二次成核现象.
Spherical Cu2O particles were prepared under high reaction concentration and without any additives using CuSO4, NaOH, and glucose as raw materials. The products were characterized by XRD, SEM and smileview software. The effects of reactant mixing modes on dispersibility and size stability of Cu2O particles were investigated. It is found that when Cu(OH)2 was prepared by slowly mixing NaOH and CuSO4 solutions at first step, and then reduced by adding glucose solution at second step, Cu2O particles were formed by so-called “rapid nucleation- slow growth” model, and well-dispersed spherical Cu2O particles with stable particle size were prepared. The good dispersibility of Cu2O particles can be explained by the slow growth of Cu2O particles, which allows the soft agglomeration of Cu2O particles to be broken by stirring and prevented from becoming hard agglomeration through chemical bond between crystal nuclei. The good particle size stability can be explained by good thermal stability of Cu(OH)2 which allows the precursor to keep oneness during heating up and prevents the renucleation in the reduction.
氧化亚铜(Cu2O)是一种p型半导体, 超细Cu2O具有奇特的光电化学性质和催化活性, 可用作光电材料、电池负极材料和光催化剂等等[ 1, 2, 3, 4]. 近年, 作者开展了以Cu2O为前驱体通过氢还原法制备电子浆料用铜粉的研究[ 5]. 由于铜粉的形貌与粒径基本上继承前驱体Cu2O的形貌与粒径特征, 而导电浆料对铜粉的分散性、形貌、粒径等性状指标要求很高, 因此需对Cu2O粒子的分散性与制备过程稳定性控制进行研究.
制备Cu2O的方法主要有固相法[ 6]、电解法[ 7, 8]、化学还原法[ 9, 10, 11, 12, 13, 14, 15, 16]、高能射线辐照法[ 17, 18]、水热法[ 19, 20]等. 但是上述方法在产品分散性、形貌、粒径等质量指标以及过程控制和工业化成本等方面存在不足. 近年来, 化学还原法特别是以葡萄糖为还原剂制备Cu2O粉末在Cu2O颗粒形貌粒径的控制上取得了一定成果, 如Zhang等[ 12]以葡萄糖为还原剂, 用PVP作添加剂, 在不同反应物浓度均制备出了八面体的Cu2O晶体, 通过PVP用量调节Cu2O的粒径; Liang等[ 13]通过D-葡萄糖还原氯化铜制备了星形和花状等不同形貌的Cu2O单晶; 赵华涛等[ 14]在将CuSO4经与NaOH反应后用葡萄糖还原, 改变加料方式和NaOH的浓度制备了不同形貌的Cu2O晶体等. 作者对高反应物浓度下葡萄糖还原Cu(Ⅱ)制备Cu2O颗粒做了初步研究, 分别用CuO和Cu(OH)2制得了方形、球形、八面体的Cu2O颗粒, 并初步探讨了其形貌粒径控制机理[ 15, 16]. 在前期工作的基础上, 本工作系统地研究了CuSO4溶液、NaOH溶液和葡萄糖溶液等三种原料的不同加料方式对Cu2O颗粒的分散性以及粒度稳定性的影响, 得到最佳的加料方式.
五水硫酸铜(CuSO4•5H2O), 氢氧化钠(NaOH), 葡萄糖(C6H12O6•H2O), 所有试剂均为分析纯, 使用前未经进一步纯化.
称取50 g CuSO4•5H2O和80 g C6H12O6•H2O, 分别配置CuSO4溶液和葡萄糖溶液各200 mL, 量取浓度为100 g/L的NaOH溶液200 mL, 按不同加料方式将上述溶液混合于1 L恒温水浴反应器, 在50℃恒温反应1 h, 所得Cu2O浆料经离心分离 (3000 r/min)后, 用纯水洗涤5次, 无水乙醇洗涤2次, 最后在65℃下鼓风干燥24 h得到产品. 溶液混合与Cu2O制备过程均在搅拌条件下进行, 搅拌速率为500 r/min. 加料方式如下:(i)将各溶液加热至50℃; 先将葡萄糖溶液和NaOH溶液加入反应器混合, 而后迅速加入CuSO4溶液(简称“铜盐后加法” ).
(ii)将各溶液加热至50℃; 先将葡萄糖溶液和CuSO4溶液加入反应器混合, 而后迅速加入NaOH溶液(简称“碱液后加法” ).
(iii)将常温的CuSO4溶液加入反应器, 而后将常温的NaOH溶液迅速与CuSO4溶液混合, 再将混合浆料加热至50℃, 最后加入预先升温至50℃的葡萄糖溶液(简称“快速混合葡萄糖后加法” ).
(iv)先将常温的CuSO4溶液加入反应器, 而后每隔10 min加入20 mL常温的NaOH溶液, 待NaOH溶液加完后继续搅拌15 min, 然后将浆料升温至50℃, 最后加入预先加热至50℃的葡萄糖溶液(简称“分步混合葡萄糖后加法” ).
用JSM-6360型扫描电镜观察粒子的形貌、粒度和分散性, 并用扫描电镜附带的smileview图像处理测量粉体颗粒的粒径, 求出粒子的数学平均粒径及标准方差并制出粒径分布图; 用X射线衍射仪(Rigaku D/max 2550型)进行物相分析(Cu Kα靶, λ=0.15406 nm, 管电压40 kV, 管电流300 mA).
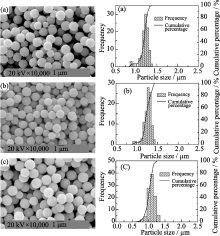
按不同加料方式制备的Cu2O粉末的SEM图像如图1所示.
1)按加料方式i进行加料时, C6H12O6 和NaOH溶液混合后的混合液为黄色, 表明葡萄糖遇碱发生了缩醛反应; 加入CuSO4后, 铜离子迅速被还原, 反应体系迅速变红. 从图1(a)中可看出, 反应后所得Cu2O颗粒团聚严重, 单体粒子为大小不一的 球形.
 | 图1 不同加料方式所得Cu2O粒子的SEM照片Fig. 1 SEM images of Cu2O particles prepared by different reactant mixing modes(a) Mode i; (b) Mode ii; (c) Mode iii; (d) Mode iv |
2)按加料方式ii进行加料时, 所得Cu2O粒子形貌与分散性与加料方式i所得产物类似, 如图1(b)所示.
3)按加料方式ⅲ进行加料时, NaOH溶液与CuSO4溶液混合后生成深蓝色的胶体; 随着温度升高, 浆料颜色变为墨绿色, 表明有部分Cu(OH)2脱水生成黑色CuO. 从图1(c)中可以看出, 还原后所得的Cu2O粒子分散性良好, 呈球形, 但大颗粒间伴有一些类球形小颗粒(1(c1)).
4)按加料方式ⅳ进行加料时, 少量NaOH溶液与CuSO4溶液混合后生成深蓝色的胶体, 搅拌后浆料颜色逐渐变浅, 表明胶体逐渐转变为颗粒状; 当NaOH溶液全部加入后, 浆料颜色变回深蓝色; 浆料颜色随温度升高变化不大, 表明NaOH分批加入得到的Cu(OH)2不易脱水, 性状稳定. 从图1(d)中可以看出, 经葡萄糖还原所得Cu2O粒子分散性良好, 呈球形, 粒径均匀.
为了考察制备工艺的重现性, 对粉体分散性好的两种加料方式进行了重复实验, 比较了其产品形貌与粒度的重现性. 需要说明的是: 以加料方式ⅲ进行重复实验时, 葡萄糖还原反应温度仍然为50℃; 以加料方式ⅳ进行了重复实验, 葡萄糖还原反应温度改为了60℃. 所得Cu2O颗粒的SEM及其对应的粒径分布图分别列于图2和图3, 粒径统计结果分别列于表1和表2.
| 表1 加料方式iii的重复实验所得Cu2O颗粒的粒径表 Table 1 Particle diameter of different Cu2O particles prepared by reactant mixing mode iii |
| 表2 加料方式iv的重复实验所得Cu2O颗粒的粒径表 Table 2 Particle diameter of different Cu2O particles prepared by reactant mixing mode iv |
从图2可以看出, 50℃时以方式ⅲ加料的重复实验均制备了分散性良好的球形Cu2O颗粒. 但是由平均粒径统计结果(表1)可知, 重复实验所得Cu2O颗粒平均粒径差异较大(0.75、0.85、1.35 μm); 由粒径分布图(图2)可知, 所得颗粒粒径分布较宽,图中存在明显的双峰, 说明反应中存在明显的二次成核现象. 加料方式ⅲ在制备Cu2O颗粒时, 虽然在分散性与颗粒形貌上满足要求, 但粉体粒径特征的可重现性差, 粒径不可控.
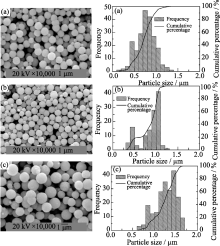 | 图2 加料方式iii的重复实验所得Cu2O颗粒的SEM照片以及粒径分布统计Fig. 2 SEM images and particle size (a, b, c) for different tests distribution of Cu2O powders prepared by reactant mixing mode iii |
从图3的SEM照片可以看出, 以加料方式ⅳ进行的重复实验均制备了分散性良好的球形Cu2O颗粒. 由平均粒径统计结果(表2)和粒径分布图(图3)可知, 各实验所得Cu2O颗粒平均粒径变化不大, 在1.30 μm左右, 粒径分布较窄. 说明了加料方式ⅳ在制备Cu2O颗粒时, 产物不仅在分散性与颗粒形貌粒径上满足要求, 而且在更高温度下仍可实现产物上述特征的重复性控制.
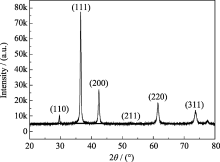
不同加料方式所制粉末的XRD分析结果显示, 虽然各粉末XRD图谱在特征峰强度与半峰宽方面存在差异, 但峰位相同, 为同一物质. 图4为本方法所制粉末的典型XRD图谱, 其特征峰与Cu2O晶体的XRD图谱完全一致, 表明产物为Cu2O, 且纯度较高.
根据Lamer模型[ 21](图5), 从液相中析出粒径均一的单分散固体颗粒, 必须控制溶质的过饱和度, 尽可能地阻止二次成核或者颗粒生长阶段中成核现象的出现, 使沉淀过程按“爆发成核, 缓慢生长”的模式进行, 体系中最终的颗粒数目与颗粒粒径决定于成核阶段. 图5中, 在阶段Ⅰ, 溶质的浓度 C不断积累, 但无晶核形成; 当 C达到成核所需的最低过饱和浓度 Cmin时, 进入成核阶段Ⅱ; 之后由于成核的大量消耗而使 C急剧降低, 当 C降回到 Cmin时, 成核阶段结束, 并进入生长阶段Ⅲ. 生长阶段一直延续到浓度 C降到接近溶解度 Cs为止.
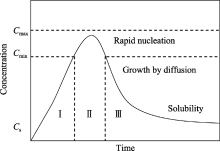 | 图5 晶体成核生长与溶质浓度的Lamer模型示意图[ 21]Fig. 5 Lamer modle of nucleation and growth dependences with concentration[ 21](I —Prenucleation; II— Nucleation; III — Growth) |
再根据Tadao Sugimoto得出的成核与生长速度的浓度关系曲线[ 21](图6), 当溶质浓度大于 Cmin时, 成核速度随着溶质浓度增加急剧增大; 在有晶核存在时, 生长速度也是随着溶质浓度的增加逐渐增大的. 因此, 如果溶质的浓度长时间在 Cmin与 Cmax之间停留, 即Lamer模型中成核过程中阶段Ⅱ延续时间过长, 必然会导致成核与生长过程的长时间共存, 这样可能得不到单分散体系.
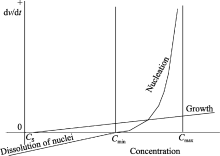 | 图6 成核与生长速度的浓度关系曲线[ 21]Fig. 6 Concentration dependences of nucleation and growth rates[ 21], where V is the total volume of the precipitate[ 21] |
粉末的团聚一般分为两种: 粉末的软团聚和硬团聚. 粉末的软团聚主要是由于颗粒间的范德华力和库仑力所致, 该团聚可以通过化学作用或施加机械能的方式来消除; 粉末的硬团聚之间除了存在范德华力和库仑力外, 还存在化学键作用. 结合实验过程与结果可知, 在以方式i和ii加料时, 所得Cu2O颗粒明显发生了硬团聚; 而以方式ⅲ和ⅳ加料时, 成功制得了单分散的Cu2O颗粒.
以方式i和ii加料时, 各反应物(Cu2+, 葡萄糖,OH-)混合时均以较高浓度存在于溶液中, 反应持续快速进行, 反应生成的Cu+的浓度长时间在 Cmin与 Cmax之间停留. 就有如下团聚情况出现: 1)早期产生的晶核由于范德华力作用相互吸引发生了软团聚; 2)在搅拌作用未及时消除初始软团聚时, 快速的生长使团聚体以化学键模式进一步桥接, 导致团聚模式转变为硬团聚; 3)后续产生的晶核以同样模式形成新的团聚体或团聚于早期团聚体表面, 使团聚现象进一步恶化.
以方式iii和iv加料时, NaOH溶液与CuSO4溶液混合后, 二价铜源主要以Cu(OH)2形式储存, 并存在有少量Cu2+、Cu(OH)+、Cu(OH)42-等离子. 葡萄糖加入后, 初始游离的Cu2+迅速反应使Cu+的浓度跃过 Cmin, 发生成核; 而后续反应所需Cu2+出自于Cu(OH)2的缓慢释放, 所以反应速率很快降低, 使得体系中Cu+的浓度迅速下降至Lamer模型中的Ⅲ区——从而停止成核, 缓慢生长, 有效地实现了Cu2O颗粒成核生长过程的分离. 上述过程中, 一方面由于固相Cu(OH)2的位阻作用避免了晶核大量团聚, 另一方面由于搅拌作用能及时消除晶核的初始软团聚, 从而在缓慢生长后得到了单分散的Cu2O颗粒.
Cu(OH)2稳定性差, 升高温度会加速Cu(OH)2的脱水分解, 上世纪四十年代Weiser等就报道了稍微过量的碱加入铜盐溶液中制得的Cu(OH)2凝胶即使在室温下也容易脱水分解. 由此, Cu(OH)2的稳定性控制成为本研究制备Cu2O颗粒过程稳定性控制的关键.
以方式ⅲ加料混合反应物时, 所得Cu2O颗粒粒径分布较宽且实验的重现性很差(图2, 表1). 这是由于一方面NaOH溶液与CuSO4溶液混合过程短暂, 前驱体中二价铜源各存在形态(Cu2+、Cu(OH)+、Cu(OH)2、Cu(OH)42-、CuO)尤其是游离的Cu2+在各批次实验的初始状态中所占比重不稳定; 另一方面, Cu(OH)2凝胶极易脱水分解为CuO, 加重了组分比重的不稳定性. 结果, 初始状态二价铜源各组分所占比重的差异使得不同批次反应的初始成核数量不同, 导致了Cu2O颗粒粒径难以重复; 各铜源组分释放Cu2+速率不同使得成核过程与生长过程难以分离, 易发生二次成核使粒径分布变宽; 另外, 前驱体CuO所占比重的提高降低了Cu2O颗粒尤其是后期粒子的球形度[ 15, 16].
以方式iv加料混合反应物时, 由于NaOH溶液加入速度缓慢, Cu(OH)2凝胶可逐渐转变为较稳定的Cu(OH)2颗粒, 抑制了Cu(OH)2的大量脱水分解现象. 因此, 二价铜源各存在形式在不同批次实验中相对稳定, 铜源组分趋于单一, 避免了二次成核. 最终, 产物形貌粒径特征重现性好, 所得Cu2O颗粒粒径分布较窄.
在不加任何添加剂和高反应物浓度的条件下, 实验在碱性体系中葡萄糖还原Cu(Ⅱ)制备了超细Cu2O颗粒. 主要考察了加料方式对Cu2O颗粒的分散性与粒度稳定性的影响, 并根据Lamer模型初步探讨了其影响机理. 所得结论如下:1) 将NaOH溶液与CuSO4溶液混合后, 二价铜源主要以Cu(OH)2形式储存. 由于Cu2+出自Cu(OH)2的缓慢释放, 使得Cu2O颗粒按“爆发成核, 缓慢生长”的模式形成.
2) Cu2O晶核的缓慢生长使搅拌作用能及时消除初始晶核的软团聚, 避免了晶核之间由于快速生长形成而化学键并发生硬团聚, 从而得到了单分散的Cu2O粒子.
3) 将NaOH溶液与CuSO4溶液分步缓慢混合后, 二价铜源各存储形态所占比重在不同批次实验中相对稳定; 并且铜源组分趋于单一, 避免了二次成核的出现. 所以产物形貌粒径特征重现性好, Cu2O颗粒粒度均匀, 制备工艺稳定.
4) 初步探讨了葡萄糖还原Cu(Ⅱ)制备Cu2O颗粒的加料方式对颗粒分散性与粒度稳定性的影响. 在后续研究中, 可在该稳定体系的基础上进一步探讨温度、浓度、pH值等因素对Cu2O颗粒形貌粒径的影响, 从而实现Cu2O颗粒制备工艺的形貌粒径可控化.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|