王 放(1987-), 女, 硕士研究生. E-mail:su_daily@126.com
在不外加无机酸的条件下, 通过水热合成法制备了短孔道六方板状有序介孔材料Zr-Ce-SBA-15 (ZCS). 以ZCS和传统SBA-15为载体对胃蛋白酶进行固定, 并利用N-(2-氨乙基)-3-氨丙基三甲氧基硅烷(AAPTS)对酶固定化材料进行功能化, 以缩小开口孔径从而减少酶泄漏. 采用小角X射线衍射、扫描电镜、透射电镜、氮气吸附和红外光谱对样品进行结构表征. 结果表明, 胃蛋白酶成功固定到介孔孔道中, AAPTS嫁接到材料中且没有破坏介孔结构. 固定化实验表明相比于SBA-15, ZCS对胃蛋白酶具有较快的吸附速度和较强的固定化能力(最大负载量为257.9 mg/g), 短孔道材料能有效地促进分子的扩散传递. 催化活性测定以牛血红蛋白为探针物, 与游离酶相比, 固定酶对牛血红蛋白保持着稳定的活性.
Short channeled Zr-Ce-SBA-15 (ZCS) mesoporous materials with hexagonal platelet morphologies were synthesized through a hydrothermal route without addition of mineral acids. Porcine pepsin was immobilized inside ZCS and conventional SBA-15 through physical adsorption. A grafting step with [1-(2-amino-ethyl)-3-aminopropryl] trimethoxysilane (AAPTS) was performed to reduce the pore openings of the host material in order to minimize the enzyme leaching. The hybrid materials were characterized by X-ray diffraction, scanning electron microscope, transmission microscope, N2 adsorption/desorption and Fourier-transform infrared spectroscope. The results confirmed that pepsin is located inside the channels of the mesoporous materials and the grafting process does not affect the mesoporous structure. The immobilization of pepsin into ZCS and SBA-15 were compared. The results demonstrate that the ZCS materials have higher adsorption rates and adsorption capacities (the maximum adsorption capacity is 257.9 mg/g) compared with SBA-15. The ZCS materials with short channels are superior to conventional SBA-15 facilitating molecular diffusion. The catalytic activity of the hybrid bioinorganic material was tested with hemoglobin. The immobilized pepsin has maintained the necessary degree of freedom to fulfill its catalytic activity.
胃蛋白酶是三大消化降解酶之一, 广泛应用于食品、药品行业. 但是蛋白酶属于可溶性酶, 受到自身降解作用, 使该酶的应用受到一定限制. 过去数十年来, 有序孔材料因具有较高的比表面积、较大的孔容、规则的孔道结构在酶固定领域受到广泛关注[ 1, 2]. 利用无机材料固定酶能够提高酶的稳定性, 固定化酶能够重复使用, 易于从反应混合物中分离且稳定性好, 酶不易被产物污染[ 3, 4]. 酶固定化常采用物理吸附, 对酶结构没有破坏且步骤简单, 但物理吸附作用力小, 酶易泄漏, 因此常利用硅烷化试剂对介孔材料进行硅烷化修饰以减小孔口直径, 减少酶从孔道内泄漏[ 5].
SBA-15有序介孔硅材料具有窄的孔径分布、高比表面积及孔容、高度有序的介孔结构, 广泛作为生物大分子的载体材料[ 6, 7]. 有序介孔材料的介观结构、介孔孔道方向及其宏观形貌都会影响基质的整体扩散和质量传递. 传统的SBA-15呈纤维状, 孔道长(微米级)且内在活性较低[ 4], 物质在长孔道内的分子扩散以及孔道堵塞是其应用于吸附领域面临的主要问题[ 8]. 短孔道有序介孔材料, 因其有利于物质在孔道内的传输和扩散, 受到了研究人员的广泛关注. 特别是具有规整形貌的短孔道介孔材料, 在酶固定等[ 9, 10]领域具有潜在应用价值. 赵东元等[ 11]对比溶菌酶在棒状SBA-15和传统SBA-15上的固定, 发现棒状SBA-15对溶菌酶的固定化速度要远远快于传统SBA-15, 研究表明介孔材料的形貌结构是影响固定化效果的关键因素. Chen等[ 8]在强酸条件下用P123作模板剂加入微量Zr(Ⅳ)合成了有机功能化的短孔道盘状SBA-15, 用于有机大分子的吸附, 短孔道板状SBA-15具有比传统的SBA-15更好的传输能力.
最近, 本课题组在不外加无机强酸的条件下合成出具有六方板状形貌、短孔道的有序介孔材料, 且介孔孔道方向垂直于六方板面[ 12]. 在前期研究的基础上, 本工作利用短孔道介孔材料固定胃蛋白酶, 同时利用AAPTS对其进行硅烷化, 并以牛血红蛋白为探针物检测固定酶的催化活性. 对比研究短孔道ZCS和传统SBA-15对胃蛋白酶固定化及其催化活性的影响.
将一定量的P123(相对分子质量=5800 Sigma- Aldrich)溶解于去离子水, 在35℃下搅拌形成胶束溶液, 然后加入正硅酸乙酯(国药集团化学试剂有限公司)及一定量的ZrOCl2·8H2O和Ce(NO3)3·6H2O. 物料配比为 n(P123): n(TEOS): n(H2O): n(ZrOCl2·8H2O): n(Ce(NO3)3·6H2O)=0.01015:1:170:0.05:0.05. 此混合物继续在35℃下恒温搅拌20 h后, 转入聚四氟乙烯作内衬的晶化釜中, 于100℃下晶化24 h, 晶化后的产物经冷却、过滤、洗涤、60℃隔夜干燥, 然后在550℃空气气氛下焙烧6 h除去模板剂, 升温速率为1 ℃/min, 得到白色粉末状固体样品, 样品标记为ZCS. 传统SBA-15的制备参见文献[ 13].
在不同pH值(2.6、3.6、4.6)条件下测试ZCS(或SBA-15)对胃蛋白酶的固定性能, 取一定量的胃蛋白酶(PEP Sigma-Aldrich)溶于不同pH值醋酸钾缓冲溶液中, 配制成2 mg/mL胃蛋白酶溶液.
取8 mL的2 mg/mL胃蛋白酶溶液于锥形瓶中, 加入40 mg ZCS(或SBA-15), 置于恒温(25℃)摇床上以一定频率于室温下震荡, 间隔一段时间之后离心分离过滤, 用双光束紫外-可见分光光度计在 280 nm处测量, 测定上清液中胃蛋白酶的浓度, 并计算胃蛋白酶的固定量.
取20 mL的2 mg/mL胃蛋白酶溶液于锥形瓶中, 加入100 mg ZCS(或SBA-15), 置于恒温(25℃)摇床上以一定频率于室温下震荡1 h, 离心分离过滤干燥, 测定上清液中胃蛋白酶的浓度, 计算胃蛋白酶的固定量. 产物标记为PEP/ZCS(或PEP/SBA-15).
将100 mg PEP/ZCS(或PEP/SBA-15)加入到 8 mL N-(2-氨乙基)-3-氨丙基三甲氧基硅烷(AAPTS,武汉天目科技发展有限公司)和20 mL甲苯的混合液中, 35℃下搅拌3 h, 混合物经离心分离、丙酮洗涤、干燥. 产物标记为PEP/ZCS/AAPTS(或PEP/ SBA-15/AAPTS).
将0.4 mL酶溶液(2 mg/mL, 醋酸钾缓冲液, pH=3.6)或相应数量的功能化酶固定材料(包含大约0.8 mg 胃蛋白酶)加入到2.0 mL牛血红蛋白溶液中(2 g/L, 醋酸钾缓冲液, pH=3.6). 首先将4.0 mL三氯乙酸溶液(5% w/ v)加入到酶溶液(或功能化酶固定材料)与底物的混合溶液中, 以阻止催化反应的进行, 上清液在280 nm处吸光度近似作为0时刻的参考值. 然后将酶溶液(或功能化酶固定材料)与底物的混合溶液搅拌20 min后加入4.0 mL三氯乙酸溶液, 通过测定上清液中吸光度的增加值计算胃蛋白酶的活性. 活性计算式为[ 14]: U/mg= [(Δ A/min) ×1000]/ [ menz di]
Δ A/min-每分钟增加的吸光度, menz-胃蛋白酶的质量, di-稀释因子.
为了考察功能化材料对酶泄漏的抑制作用, 将50 mg功能化及未功能化酶固定材料分别加入到 10 mL醋酸钾缓冲液(pH=3.6)中, 室温下震荡1 h, 随后离心分离, 测定上清液酶浓度, 以此计算泄漏的酶占原材料中固定酶量的百分比.
PEP/ZCS/AAPTS(或PEP/SBA-15/AAPTS)的稳定性测试以牛血红蛋白为底物, 经过4个催化循环. 每个循环后, 5000 r/min离心5 min分离出材料, 并测得每个循环酶固定材料的活性.
小角X射线衍射(LXRD)由Bruker D8粉末衍射仪(CuKα)测定, 采用Ni滤光片, 在管电压40 kV, 管电流40 mA的情况下扫描. 透射电镜(TEM)测试在日本JEOL公司JEM-2100型透射电镜上进行, 电压200 kV, 测试前样品在乙醇中超声处理5 min后, 分散在铜网上进行观察. 扫描电镜(SEM)分析在日本JEOL公司JSM-6380LV扫描电镜上完成. N2吸附- 脱附等温线用Micromeritics ASAP 2020装置在液氮77 K测定. 比表面积按照Barrett-Emmett-Teller (BET)方法计算, 孔容以及孔径分布采用吸附支曲线通过Barrett-Joyner-Halenda (BJH)模型计算. 红外光谱(FTIR)分析采用加拿大Bomen公司MB154SF T2IR红外光谱仪(KBr压片). 胃蛋白酶浓度采用北京普析通用仪器有限公司的双光束紫外可见分光光度计测定.
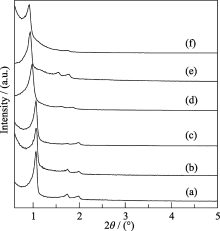
图1为空白载体SBA-15和ZCS固定胃蛋白酶及功能化前后的小角XRD图谱, 从图中可以看出, SBA-15及ZCS在2 θ=0.6°~2°区间内均出现三个衍射峰, 分别对应于(100)、(110)和(200)晶面的特征衍射峰, 这是六方相介孔结构的典型特征衍射峰, 说明样品呈现高度有序的二维六方介观结构(空间群P6mm)[ 15, 16]. 固定胃蛋白酶之后, 样品PEP/SBA- 15和PEP/ZCS的三个特征衍射峰强度略有降低, 说明固定胃蛋白酶对材料的有序度基本没有影响. 经过功能化得到的样品PEP/SBA-15/AAPTS和PEP/ZCS/AAPTS的(110)和(200)晶面的特征衍射峰仍能辨出, 证明功能化后样品仍呈现高度有序的二维六方介观结构.
图2(a)为空白载体ZCS的SEM照片, 从图中可以看出, ZCS与传统SBA-15(图2(c))的形貌差异很大. 传统SBA-15呈现典型的竹节状结构, 孔道长度为微米级, 约为1.2 μm. 而ZCS则呈规则的六方板状结构, 颗粒的大小约为1.0~1.2 μm, 厚度(孔道长度方向)在0.4~0.5 μm之间, 仅为传统SBA-15的1/3左右. 图2(b)为空白载体ZCS的TEM照片, 样品呈现高度有序的二维六方介孔结构, 六方孔道排列规则, 且介孔孔道方向平行于短轴.
 | 图2 空白载体SBA-15及ZCS的SEM和TEM照片Fig. 2 SEM and TEM images of ZCS and SBA-15(a) ZCS (SEM); (b) ZCS (TEM); (c) SBA-15 (SEM); (d) SBA-15 (TEM) |
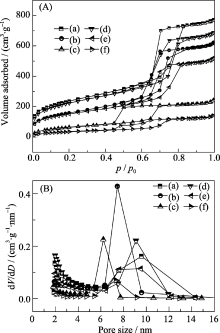
图3为空白载体SBA-15和ZCS固定胃蛋白酶及功能化前后的N2吸附-脱附等温线和相应的孔径分布图. N2吸附-脱附等温曲线显示样品具有相同的N2吸附-脱附行为, 均为典型的IUPAC分类中的Ⅳ型曲线, 并具有H1型回滞环, 这是典型的介孔结构, 说明固定酶及功能化以后材料均保留原有高度有序的介孔结构. 这与小角度XRD分析结果相符. 此外, 功能化后等温线出现明显突变的相对压力稍向减小的方向移动, 说明接枝氨基后材料的孔径有所减小, 这一点可以从孔径分布图得到验证. 表1列出了样品的孔结构参数, 由表中数据可知, 固定酶及功能化后的样品其比表面积、孔容和孔径都有不同程度的降低, 说明大量酶进入介孔孔道中, 有机功能基团成功嫁接在介孔孔道的内表面.
| 表1 样品的结构性能 Table 1 Textural properties of samples |
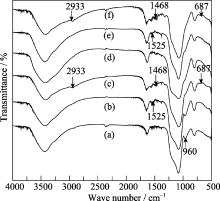
图4为固定酶及功能化前后样品的红外图谱. 样品中均出现了SiO2的红外吸收特征峰, 3400 cm-1处的较宽谱带是缔合的-OH伸缩振动引起的, 1640 cm-1处的谱带代表Si-OH的伸缩振动, 1085和795 cm-1处分别为Si-O-Si 反对称伸缩振动和对称伸缩振动[ 17]. 对比胃蛋白酶固定化前后的样品可以看出, 固定胃蛋白酶后的样品(PEP/SBA-15(b), PEP/ SBA-15/AAPTS(c), PEP/ZCS(e), PEP/ZCS/AAPTS(f))均在1525 cm-1附近出现了一个弱峰, 这是C-N伸缩振动和N-H弯曲振动的吸收峰[ 18, 19], 属于酶的典型特征峰. 经过AAPTS功能化后, PEP/SBA-15/ AAPTS和PEP/ZCS/AAPTS均在2933、1468和 687 cm-1处出现新峰, 在2933和1468 cm-1处出现的峰可归属为-CH2的C-H伸缩振动及反对称弯曲振动吸收峰[ 20]; 在687 cm-1处出现的弱峰为N-H的弯曲振动吸收峰. -NH2的对称和反对称伸缩振动吸收峰出现在3400~3000 cm-1处, 与SiO2表面羟基的伸缩振动吸收峰重叠. 这证明AAPTS已成功地嫁接到PEP/ SBA-15和PEP/ZCS. 另外, SBA-15中位于960 cm-1处的峰代表Si-OH的弯曲振动, 它在经硅烷化修饰之后完全消失, 说明分子筛表面的硅羟基与有机硅烷发生了反应. 由此可以证明, 硅烷化试剂已经与分子筛表面的硅羟基发生了充分反应, 从而将-NH2引入分子筛的表面.
图5为空白载体SBA-15和ZCS在不同pH(2.6、3.6、4.6)条件下对胃蛋白酶的吸附曲线, 从图中可以看出, 在相同pH条件下, ZCS对胃蛋白酶的吸附速度比SBA-15对胃蛋白酶的吸附速度快, ZCS对胃蛋白酶的吸附曲线在初始9 min内就有很明显的上升, 在12 min时基本达到吸附平衡, 而SBA-15对胃蛋白酶的吸附在60 min时基本达到吸附平衡. 此外, 在相同pH条件下, ZCS对胃蛋白酶的吸附量明显比SBA-15要大, ZCS表现比SBA-15具有更强的吸附能力. SBA-15的比表面积和孔容虽然大于ZCS, 但是 SBA-15的孔道较长, 微米级的孔道不利于物质在孔道内的扩散和传输[ 21], 孔道易被胃蛋白酶堵塞, 不仅影响了吸附速率, 同时也阻碍了材料对胃蛋白酶的进一步吸附. 胃蛋白酶无法进入到孔道深处, 使得SBA-15对胃蛋白酶的有效吸附孔容大大减少, 进而降低了胃蛋白酶的吸附量. ZCS为六方板状形貌, 其介孔孔道较短(400 nm), 胃蛋白酶扩散路径变短, 有效促进胃蛋白酶在孔道内的扩散传输, 一方面使得材料快速达到吸附平衡, 另一方面也充分保证了ZCS对胃蛋白酶的有效吸附孔容, 从而使ZCS具有较强的吸附能力, ZCS比传统SBA-15显示出更强的传输能力.
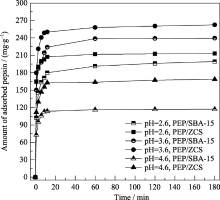 | 图5 空白载体SBA-15 和 ZCS对胃蛋白酶的吸附曲线Fig. 5 Adsorption curves of the amount of adsorbed pepsin within SBA-15 and ZCS |
对比三个pH条件下载体对胃蛋白酶的吸附量可以看出, ZCS和SBA-15均在pH=3.6条件下对胃蛋白酶的吸附量最大. 吸附时间为60 min, pH为3.6时ZCS和SBA-15对胃蛋白酶的吸附量分别为257.9和238.6 mg/g, 而不论升高或降低pH, 吸附量都有明显下降, 因此, pH=3.6是吸附固定胃蛋白酶的最佳pH. 胃蛋白酶的等电位为1, pH为3.6时, 胃蛋白酶显负电性, 而据文献报道, SBA-15的等电位在2.7[ 22]到3.7[ 23, 24]之间. 本实验所用的pH为3.6接近于硅的等电位的临界值. 在这种条件下, 很难确定SBA-15和ZCS表面的绝对电荷. 实验数据已经证明, pH=3.6时胃蛋白酶成功地固定到介孔硅材料中, 但是吸附机理仍然没有完全清楚. 胃蛋白酶的吸附推动力可能是静电作用力、氢键作用和疏水作用. 由于蛋白质分子比较复杂, 因此很难确定哪种作用力起主导作用, 有可能是这几种作用力协同作用.
表2中列出了不同材料的相对酶泄漏量, 相比于未功能化材料, 功能化材料的酶泄漏量大大降低. 说明功能化有效阻止了固定化材料中酶的泄漏.
| 表2 样品的酶泄漏量 Table 2 Leakage of adsorbed enzyme |
表3中列出了游离酶、酶固定化材料PEP/ SBA-15、PEP/ZCS及酶固定化且功能化后的材料PEP/SBA-15/AAPTS、PEP/ZCS/AAPTS对牛血红蛋白的催化活性数据. 经测试空白SBA-15及ZCS对牛血红蛋白没有催化分解作用, 没有检测到水解产物. 游离酶的活性定义为100%活性, 从表中可以看出, PEP/ZCS对牛血红蛋白的初始相对催化活性明显高于PEP/SBA-15, 这可能是因为牛血红蛋白分子较大, 而PEP/SBA-15的孔道较长, 从而引起孔道堵塞, 影响了催化活性, 而PEP/ZCS为短孔道材料, 有利于牛血红蛋白分子在孔道内的传输, 有效减少孔道堵塞. 功能化后的材料也有类似的规律.
| 表3 样品的催化活性 Table 3 Catalytic activity test for peptic hydrolysis |
对比功能化前后的样品, 可以看出, 对应的样品功能化前的初始催化活性要高于功能化后的, 一方面可能是因为牛血红蛋白分子较大, 而功能化后样品由于硅烷化修饰缩小了开口孔径, 从而减缓了牛血红蛋白进入介孔孔道, 导致催化活性的下降; 另一方面可能是功能化过程对胃蛋白酶的活性造成了一定的影响. 但经过4次循环后, 未功能化样品PEP/SBA-15及PEP/ZCS由于酶泄漏, 催化活性急剧下降, 相对活性分别从25.6%和33.6%下降到10.6%和9.6%. 而功能化样品PEP/SBA-15/AAPTS及PEP/ZCS/AAPTS对牛血红蛋白的催化活性基本保持不变, 这说明了功能化缩小了介孔材料的开口孔径, 有效阻止了酶泄露, 保证了酶固定化材料的重复利用性.
以短孔道有序介孔材料ZCS和传统SBA-15为载体对胃蛋白酶进行固定, 并对其进行功能化修饰. 结果表明胃蛋白酶成功固定到介孔孔道中,功能化修饰对介孔结构没有影响且有效阻止了酶泄漏. 相对长孔道SBA-15, 短孔道ZCS能有效地促进分子的扩散传递, 对胃蛋白酶具有更强的固定化能力. 短孔道酶固定材料有利于大分子牛血红蛋白的催化水解, 且具备一定的重复使用性. 这种短孔道介孔材料有望在酶固定、吸附、催化等方面得到广泛应用.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|