陈 于(1973-), 硕士. E-mail: yueryw@sina.com 通迅作者: 苏佳灿,副教授. E-mail:sujiacan@yahoo.com.cn
以十六烷基三甲基溴化铵(CTAB)为模板, 用溶胶-凝胶法合成了掺杂钙银介孔氧化硅凝胶(m-SCA)抗菌止血材料. 结果表明: m-SCA具有介孔结构, 比表面积为416 m2/g, 孔径在2 nm左右. 高比表面积的m-SCA具有很好的凝血功能, 能明显缩短血液的凝血酶原时间(PT)和部分凝血活酶时间(APTT). 含少量银的m-SCA对其凝血性能没有明显影响, 而m-SCA中的钙能促进凝血. 含银0.02wt%的m-SCA无细胞毒性, 对大肠杆菌有明显的抑制作用. 动物试验表明: m-SCA具有很好的止血性能, 能阻止兔耳伤口的流血并缩短其流血时间. m-SCA是一种有很好应用前景的抗菌止血材料.
An antibacterial hemostatic material of mesoporous silicon oxide gel doped with Ca and Ag (m-SCA) gel was fabricated by using cetyltrimethylammonium bromide(CTAB) as templates and Sol-Gel process. The results showed that m-SCA with mesoporous structure had the surface area of 416 m2/g and pore size of around 2 nm. The m-SCA with high surface area and good clotting function could significantly shorten the prothrombin time (PT) and activated partial thromboplastin time (APTT). The m-SCA containing a small quantity of Ag had no obvious effects on its clotting properties while Ca in m-SCA could promote clotting. The m-SCA doped 0.02wt% Ag without cytotoxicity had good antibacterial properties against
在各种突发性事件中, 人体创伤出血非常常见, 止血是抢救生命的关键环节[ 1]. 创伤急救的主要目的是暂时性控制出血, 尽快将伤口与外界隔离以减少感染机会, 为清创创造良好的创面条件[ 2]. 近年来, 医用止血材料的研究引起了广泛关注[ 3], 已研究的创面止血材料主要有: 纤维蛋白胶、胶原蛋白、壳聚糖、羧甲基纤维素、无机微孔材料如沸石等[ 4, 5, 6].
介孔材料是孔径介于2~50 nm的多孔材料, 由于其具有均一可调的介孔孔径、规则的纳米孔道及巨大的比表面积和孔容, 可用作生物吸附剂、生物催化剂及载体[ 7]. 最近的研究表明, 介孔材料由于具有很强的吸附性, 在止血材料方面有潜在的应用前景[ 8]. 有研究用改进的溶胶-凝胶工艺合成了纳米介孔结构的硅干凝胶, 并对其止血性能进行了研究. 结果表明: 硅干凝胶对内、外源性凝血因子活性有明显的促进作用, 材料对兔耳缘静脉止血效果良好, 但是该研究制备的硅干凝胶是无序介孔, 比表面积、孔隙率及孔的结构都无法很好的控制[ 9]. 有研究经过溶胶-凝胶法合成了具有高效止血功能的介孔氧化硅分子筛[ 10].
在外部伤口处理中, 伤口很容易由于感染而发炎, 导致伤口愈合延缓, 假如能有效地遏制发炎症状, 那么将大大缩小伤口愈合的周期[ 11], 银离子有很强的杀菌能力, 是一种广谱抗菌剂, 银系抗菌材料已有很多研究[ 12, 13]. 钙离子是一种凝血因子, 可以促进血液凝结[ 14]. 因此, 本研究将钙和银离子掺杂到氧化硅凝胶中合成了一种新型的抗菌止血材料, 并研究其理化及止血性能.
用溶胶-凝胶工艺制备掺杂钙银介孔氧化硅凝胶(m-SCA). 将40 g的十六烷基三甲基溴化铵 (CTAB)溶于600 mL去离子水中, 在温度50℃, 用恒温磁力搅拌器搅拌溶液至澄清, 加入一定量(根据试验方案)的硝酸钙和硝酸银并溶解至澄清. 加入500 mL的正硅酸乙酯(TEOS), 继续搅拌约30 min, 用1 mol/L 稀盐酸调节pH值为3左右, 继续加热搅拌, 反应6 h后, 形成稳定透明的溶胶. 将溶胶于室温陈化、干燥. 最后再以1 ℃/min升温速度加热至600℃煅烧, 保温6 h后, 得到掺杂钙银介孔氧化硅凝胶. 将m-SCA研磨成粉末, 在真空条件下对样品喷金, 用扫描电子显微镜(SEM)观察材料的微观形貌, 用透射电镜(TEM)观察材料的微观结构. 用物理吸附分析仪测定不同相对压力 P/ P0下N2等温吸附-脱附曲线, 通过BET计算材料的比表面积和孔容, 根据Barrett-Joyner-Helen(BJH)计算出m-SCA的平均孔径. 用同样的方法合成不同钙含量的介孔氧化硅凝胶(m-SC)和常规氧化硅凝胶(SD)作为对照样品.
根据ISO:10993-5细胞毒性测试标准, 在37℃下, 掺杂5wt%钙和0.02wt%银的介孔氧化硅凝胶(掺杂5wt%钙的介孔氧化硅和常规氧化硅为对照样)在无血清细胞培养基中(200 mg/mL, 材料/培养液)浸泡24 h, 得到浸提液. 将L929细胞以2×104/孔的浓度接种到96孔培养板, 继续孵育1 d后, 弃去培养基; 磷酸缓冲溶液(PBS)清洗3次, 加入含10% 胎牛血清(FBS)的浸提液, 继续培养1 d; 不加浸提液的作为空白对照组. 于测试时间, 每孔加入30 mL的四唑盐(MTT), 继续孵育培养4 h后, 弃去培养液, 用PBS清洗3次, 每孔加入100 mL的二甲亚砜(DMSO), 室温静置15 min后, 用酶标仪在560 nm波长处, 测溶液的吸光度(optical density, OD)值.
用大肠杆菌( E. coli)ATCC 87399为细菌模型, 用计数法测试掺杂钙银介孔氧化硅凝胶的抗菌性能(掺杂钙为5wt%, 银为0.02wt%). 先把m-SCA(SD和m-SC为对照样)用70%的酒精消毒, 称0.5 mg放入0.05 mL的细菌溶液中(3.25 × 104 CFU/mL), 用聚乙烯板盖好. 在湿度大于90%和37℃温度下, 培养24 h. 用10 mL生理盐水洗涤, 取0.2 mL洗液放到含营养成份的琼脂上, 在湿度大于90%和温度37℃条件下, 分别培养1和12 h, 数活细菌的数目. 抑菌率用下式计算:
R = 100%× ( B - C)/ B
R是抗菌率(%), B是空白组的平均细菌数目(CFU/样品), C是实验组的平均细菌数目(CFU/样品).
称5 g掺杂钙银介孔氧化硅凝胶( Wo), 将材料放入小烧杯中, 加入去离子水, 3 min后吸去多余的水, 称吸水后的m-SCA重量( Wwet), 材料的吸水率:
吸水率 = 100% × ( Wwet - W0)/ W0
用凝血酶原时间(PT)和部分凝血活酶时间(APTT)两个凝血指标来考察m-SCA的凝血性能. 用乌拉坦麻醉(0.4 μL/100 mg体重)大鼠后, 从大鼠腹主动脉处抽取血液, 并及时加入抗凝剂枸橼酸钙 (0.109 mol/L, 1:9)防止血液凝结, 在4℃、3000 r/min条件下, 冷冻离心制得贫血小板血浆. 根据实验设计方案, 在试管内加入贫血小板血浆和m-SCA粉末, 快速加入PT试剂, 并置于37℃培养箱培养, 迅速摇匀, 并记录血液凝固时间(凝血酶原时间, PT). 根据实验设计方案, 在试管内, 加入贫血小板血浆和m-SCA粉末, 迅速将二者混合均匀后, 在37℃培养箱中培养, 加入CaCl2溶液, 仔细观察并记录出现纤维蛋白丝的时间(部分凝血活酶时间, APTT). 用SD和m-SC作为对照样.
动物的止血实验用新西兰大白兔(体重2 kg, 雄兔)为试验对象. 兔耳部伤口止血实验: 称取m-SCA及对照样品(SD和m-SC为对照样)各若干份. 新西兰大白兔固定在实验箱内, 不麻醉. 选择大白兔耳部作为实验部位, 用刀片横向划开皮肤, 迅速将m-SCA粉末撒在伤口上, 并用棉球轻按一定时间, 除去压力后, 如果棉球周围无渗血即为止血, 用秒表确定止血时间. 用同样方法测试对照样品的血流时间.
图1(a)是掺杂5wt% Ca和0.02wt% Ag的介孔氧化硅凝胶(m-SCA)的扫描电镜(SEM)照片. 从图中可以看出, m-SCA是固体小颗粒, 近似于球形, 颗粒大小在2 μm左右, 与不掺杂钙银的介孔氧化硅凝胶没有明显的区别(图1(c)). 图1(b)是m-SCA的透射电镜(TEM)照片, 在电镜下观察, m-SCA表面具有蜂窝状的孔结构, 孔径大小为几个纳米, 与不掺杂钙银的介孔氧化硅凝胶没有明显的区别(图1(d))[ 15]. SEM和TEM结果说明掺杂钙银对介孔氧化硅凝胶的微观形貌没有明显的影响. 用表面活性剂CTAB作为模板可以制备具有介孔结构的掺杂钙银介孔氧化硅凝胶材料.
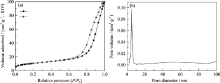
图2(a)是掺杂5wt%钙和0.02wt%银介孔氧化硅凝胶的氮气吸附曲线, 氮气吸附-脱附等温线表明: m-SCA的吸附等温线属于Langmiur Ⅳ型曲线, 在高相对压力区, 吸附等温线上出现了一个突跃, 脱附线与吸附线之间形成了较小的封闭回滞环, 根据Brunauer-Deming-Deming-Teller (BDDT) 分类可知: m-SCA具有介孔尺寸孔道结构. 图2(b)是m-SCA的孔径分布, 可见材料的孔径分布比较窄, 孔径集中在2 nm附近. 从BET和BJH计算可得: m-SCA的比表面积为416 m2/g, 平均孔径为2 nm(未掺杂钙银介孔氧化硅凝胶为435 m2/g, 平均孔径也在2 nm左右). 从氮气吸附数据来看, 在介孔氧化硅凝胶加入少量的银, m-SCA的比表面积有减小的趋势(变化不明显), 而材料的孔径没有明显变化.
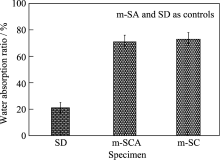
图3显示的是掺杂5wt%钙和0.02wt%银介孔氧化硅凝胶的吸水性能, 吸水率为71%, 钙掺杂介孔氧化硅凝胶的吸水率为73%, 都具有很强的吸水性能; 两者之间没有明显的区别, 这可能是加入的微量银对钙掺杂介孔氧化硅的微结构没有明显的影响, 不影响其吸水性能. 而常规氧化硅仅为21%, 这是由于介孔氧化硅具有很大的比表面积和孔容,使其具有很强的吸水性能. 结果显示: m-SA具有很好的吸水性能, 是一类有潜力的止血材料. 有研究表明: 介孔材料可选择性地吸收血液中的水, 导致血液浓缩, 激活凝血因子, 加速凝血, 达到快速止血[ 16]. 在各种创伤中, 出血是伤者死亡的重要原因之一, 及时有效地止血, 能为伤者赢得宝贵时间, 而后送到医院进行救治, 可显著降低伤者死亡率[ 17].
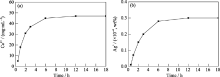
图4为掺杂5wt% Ca和0.02wt% Ag介孔氧化硅凝胶在磷酸缓冲溶液(PBS)中随时间而释放钙银离子的情况, 由图可见, 钙银离子都可以从介孔氧化硅释放到PBS溶液中, 刚开始两种离子都释放较快, 12 h后, 钙离子释放速度基本稳定, 说明磷酸缓冲溶液中的钙离子浓度达到了一个平台. 而银离子释放速度较慢, 可以维持较长时间, 缓慢释放. 这些结果表明: 当掺杂钙银介孔氧化硅凝胶接触液体时, 钙和银离子会从材料中以不同的速度释放出来.
2.5.1 介孔结构对材料凝血性能的影响
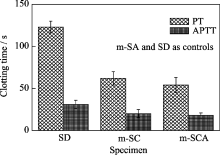
图5显示的是掺杂5wt% Ca和0.02wt% Ag的m-SCA的体外凝血酶原时间(PT, 62 s)和部分凝血活酶时间(APTT, 20 s), 5wt% Ca介孔氧化硅和常规掺杂氧化硅为对照. 由图5可见, 和常规氧化硅凝胶的凝血时间PT(172 s)和APTT(39 s)相比, m-SCA的APTT和PT凝血时间明显缩短, 这是由于m-SCA具有很高的比表面积和孔容, 因而材料具有很强的吸附力, 能迅速吸收血液中水分, 导致血液浓缩, 使血液产生凝结. 结果表明: 掺杂钙银介孔氧化硅凝胶具有很好的凝血性能. 另外, 与m-SCA的凝血时间相比, m-SC的PT和APTT(61和18s)没有明显区别, 说明载微量的银对m-SCA的凝血性能没有明显的影响; 影响m-SCA凝血性能的主要因素是材料的介孔结构(高比表面积导致材料强的吸附性).
2.5.2 钙含量对材料凝血性能的影响
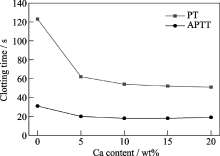
图6显示的是不同钙含量对掺杂钙银介孔氧化硅凝胶的体外凝血酶原时间(PT)和部分凝血活酶时间(APTT)的影响. 由图可见, 随着m-SCA中钙含量的增加, 材料的凝血时间缩短. 相对于未掺杂钙的含银(0.02wt%)介孔氧化硅凝胶的凝血性能(PT: 123 s和APTT: 31 s), 掺杂5wt% Ca能著提高了m-SCA的凝血性能(PT: 62 s和APTT: 20 s), 凝血时间缩短明显. 随着钙含量的增加, m-SCA(Ca: 10wt%)的凝血时间(PT: 54s和APTT: 18s)进一步缩短, 凝血性能有所提高. 继续增加钙含量, 材料的凝血性能变化不明显. 结果表明: 钙含量对m-SCA的凝血性能(PT和APTT)有明显的影响. 有研究表明: 钙离子是一种凝血因子, 可促进血液凝结[ 18], 本研究结果表明: 一定量的钙掺杂于材料中, 可以促进凝血, 这对于设计止血材料具有一定的指导意义.
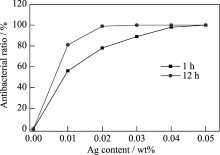
图7显示了银含量对m-SCA抗菌性能的影响, 由图可见, 银含量对m-SCA(含5wt% Ca)抗菌(大肠杆菌)在1 h和12 h性能有明显影响, 用抑菌率来表征. 随着银含量的增加, m-SCA的抗菌性能提高. 当材料含银量为0.02wt%, 与大肠杆菌培养 1 h, m-SCA具有明显的抗菌作用, 抑菌率达到82%. 与大肠杆菌培养培养12 h, m-SCA的抑菌率达到99%. 结果表明: 含银量为0.02wt%就足以保证m-SCA具有优良的抗菌性能, 不需要再增加银含量, 过多的银含量, 使材料对细胞有毒性作用. 通过实验优化, 可以认为加入0.02wt% Ag的m-SCA具有优良的抗菌性能, 可应用于抗菌止血材料.
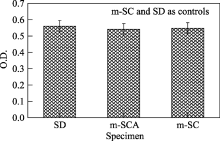
制备m-SCA目的在于开发新型的创伤止血敷料(医用卫生材料), 作为接触人体的医用材料, 止血材料首先要求具有安全性, 对人体无毒副作用. 本研究通过降低银含量来达到m-SCA对人体无毒性作用(根据预试验, 确定m-SCA银的含量为0.02wt%, 按国标-生物安全性确定). 本试验用细胞培养来考察m-SCA对细胞增殖的影响, 验证材料对细胞是否有毒性, 试验结果如图8, 与对照样品(掺杂5wt% Ca的介孔氧化硅和常规氧化硅)对比, 掺杂0.02wt% Ag的m-SCA对细胞生长没有明显的影响, 即材料对细胞无毒性(符合安全性标准). 结果表明: m-SCA具有很好的细胞相容性和生物安全性, 可用作医用卫生材料.
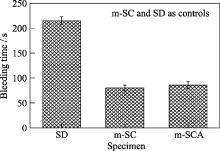
掺杂钙银介孔氧化硅凝胶的兔耳部止血实验见图9, 掺杂钙介孔氧化硅和常规氧化硅为对照. 和SD相比, m-SCA和m-SC覆盖后的伤口的流血时间明显减少, 只有80 s, 而用SD覆盖后的伤口流血时间为215 s. 结果表明: 介孔氧化硅凝胶使伤口的流血时间明显缩短, 加快了止血过程. 用m-SC, 伤口的流血时间最短(80 s), 用m-SCA, 伤口的流血时间为86 s, m-SCA和m-SC覆盖伤口后的流血时间无明显区别, m-SCA有抗菌作用, 可防止伤口感染. 血液接触m-SCA后, 由于材料迅速吸收血液中水分, 形成血凝块, 从而加快凝血反应. 与正常凝血产生的血凝块比较, 含有m-SCA的血凝块强度更大, 材料能耐受出血部位血液较大的压力, 因此, m-SCA可用于外伤快速止血. 传统的止血方法如加压、敷料填塞和止血带等, 通过压力止血, 用止血带止血还会造成远端组织缺血和代谢异常导致并发症[ 19]. 掺杂钙银介孔氧化硅凝胶不仅止血迅速, 效率高, 操作简便, 且不像止血带那样以阻断远断组织的血流为代价, 保证远端肢体有血供. 因此, m-SCA适合用于创伤急救的快速止血.
以十六烷基三甲基溴化铵(CTAB)为介孔模板, 合成了掺杂钙银介孔氧化硅凝(m-SCA)抗菌止血材料, 该材料由于存在介孔尺寸的孔道结构(孔径在2 nm左右), 具有高的比表面积, 因而具有很强的吸附性. m-SCA可选择性地吸收血液中的水, 导致血液浓缩, 激活凝血因子, 从而加速凝血, 促进止血. m-SCA能有效地促进血液凝结, 明显地缩短血液PT和APTT的凝血时间. 与含5wt% Ca的介孔氧化硅凝胶(m-SC)相比, 载 0.02wt% Ag的m-SCA对其凝血性能没有明显的影响. 另外, m-SCA对大肠杆菌具有明显的抑菌作用, 细胞毒性实验显示: m-SCA无细胞毒性, 生物安全性符合国标. 动物实验结果说明: m-SCA具有很好的止血性能, 能够阻止兔耳部伤口的流血, 缩短伤口的流血时间. 掺杂钙银介孔氧化硅凝兼具止血和抗菌双重功能, 是一种新型的抗菌止血材料, 具有潜在的临床应用前景.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|