刘 灿(1988-), 男, 硕士研究生. E-mail:liucan111@yahoo.com.cn
Cu2O, TiO2 and composite Cu2O/TiO2 films were deposited on slide glass by direct current (DC) reactive magnetron sputtering. X-ray diffraction (XRD), scanning electron microscope (SEM) and energy-dispersive spectrometry (EDS) were applied to characterize crystal structure, morphology and composition of the films, respectively. Photocatalytic activity was evaluated by the degradation of methylene blue (MB) with Xenon lamp. XRD results show that besides the initial (111) crystal plane at sputtering time of 5 min, (110) and (220) crystal planes gradually develop on the Cu2O film with the increase of sputtering time. Our calculation result indicates that (111) crystal plane is more beneficial to absorption of O2than other crystal planes. The photocatalytic activity of the Cu2O/TiO2 composite films first increases with increasing Cu2O-deposited content, and then reaches the highest value when the deposited content of Cu2O is 2.6mol%, and successively undergoes a drop. The enhancement of the photocatalytic activity is mainly attributed to alleviate the recombination of electron-hole pairs. Excessive Cu2O will prolong the time for transferring of electrons to Cu2O/TiO2interface and holes to surface, which increases the recombination probability of electrons and holes, and thus reduces the quantum efficiency.
半导体光催化技术可以将水中难于生物降解的有机物质彻底矿化, 具有除净度高、分解速率快和易操作等优点[ 1, 2, 3, 4]. TiO2以其催化活性高、氧化能力强、无毒、稳定性好而最为常用[ 5, 6, 7]. 但是, 其禁带宽度较大, 太阳光的利用率较低, 光催化效率低[ 8, 9, 10]. 减少光生空穴电子复合的一个有效方法是将TiO2与某些窄带半导体进行复合[ 11, 12, 13]. Cu2O是一种能被可见光激发的p型半导体, 禁带宽度大约为 2.2 eV[ 14, 15, 16], 并且可与表面吸附的活性氧生成高活性的物质[ 17], 已有研究证明Cu2O是良好的可见光催化剂[ 18]. 但是, 单一的Cu2O比较活泼, 且光生电子和空穴容易复合. 若将Cu2O与TiO2复合, 利用二者导带及价带位置的差别, 光生电子由Cu2O的导带注入到TiO2的导带上, 同时TiO2的光生空穴也会向Cu2O的价带迁移, 促进电子和空穴的分离, 提高光催化效率[ 11, 19, 20, 21]. 为了克服悬浮催化剂难以回收的缺点, 本实验采用直流反应磁控溅射的方法, 制备了Cu2O及不同Cu2O含量的Cu2O/TiO2叠层复合薄膜, 通过对模拟污染物亚甲基蓝(MB)进行光催化降解, 研究了各种薄膜的光催化性能.
实验采用JGP450型涡轮泵高分辨率离子溅射仪(中科院沈阳科仪研制中心有限公司).
溅射Cu2O薄膜的制备条件为: 纯度为99.97%铜靶, 尺寸为60 mm×3 mm. 溅射气体和反应气体分别为高纯氩气(99.99%)和高纯氧气(99.99%). 实验衬底为普通玻璃(2.5 mm×3.8 mm), 使用前衬底依次在丙酮、乙醇和去离子水中超声清洗, 然后吹干备用. 溅射本底真空为1.0×10-3 Pa, 沉积过程中保持反应压强在1.0 Pa, 通入的氩、氧质量流量比为27:3, 溅射功率为100 W, 衬底温度为300℃, 薄膜沉积时间为5、15和30 min. 每次溅射前, 须在Ar气氛中预溅射2 min以除去靶表面的氧化物.
溅射TiO2薄膜的制备条件为: 纯度为99.995%钛靶, 通入的氩氧质量流量比为10:2, Ti靶溅射功率为100 W, 衬底不加温, 将得到的薄膜放入管式炉中经过500℃煅烧退火3 h.
Cu2O/TiO2叠层复合薄膜制备条件为: 以退火后的TiO2薄膜为衬底, 再按照之前溅射Cu2O的条件沉积不同时间的Cu2O, 得到不同Cu2O厚度的Cu2O/TiO2叠层复合薄膜. 需要指出的是, 由于生成Cu2O和TiO2的氧气浓度不同, 很难通过溅射的方法获得Cu2O/TiO2混合结构的复合薄膜.
用X射线衍射仪(XRD, XRD-6000, Shimadzu)对沉积氧化物的晶体结构进行表征, X射线能谱仪(EDS, OXFORD Link-ISIS-300)对薄膜的元素组成进行分析. 场发射扫描电镜(FEI Nova 400, Peabody, MA, Netherlands)对薄膜的表面形貌进行了分析. 通过EDS表征不同厚度Cu2O的复合薄膜中铜和钛元素含量的比值, 进而得到各种氧化物的组成含量.
采用Materials Studio软件中DMoL3程序来模拟Cu2O(111)和Cu2O(110)的几何构型和电子构型, 三层(2×2)的Cu2O(111)和Cu2O(110)表面的超晶胞的平板模型上. 全部计算工作使用DMol3程序包进行. 计算采用effective core potentials对原子内层电子冻结; 价电子采用双数值基组加极化函数展开(DNP); 交换相关势采用广义梯度近似和Perdew- Wang-91泛函(GGA-PW91)相结合的方法. 对各模型优化时, 将超晶胞平板模型的最底层固定, 采用1×1×1的Monkhorst-Pack K点计算氧分子在Cu2O不同晶面的吸附能.定义O2的吸附能为 Eabs(单位为kJ/mol), 其计算式为:
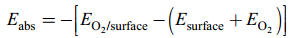 | (1) |
由于(220)晶面表面结构与(110)晶面相同, 因此只计算了(111)和(110)两个晶面作为对比.
光催化效果分析是利用模拟太阳光的氙灯(100 W, 北京畅拓)垂直照射薄膜分解溶液中的MB完成的. 通过紫外-可见分光光度仪(TU-1901, 北京普析通用仪器有限责任公司)测定640 nm的吸光度的变化, 计算得到光催化降解率( c0- c)/ c0.
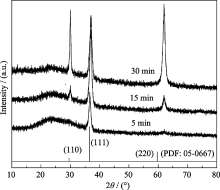
图1是不同溅射时间获得的Cu2O薄膜的XRD图谱, 从图中可以看出, 氧化物衍射峰出峰位置在29.55°、36.40°和61.34°, 分别对应Cu2O的(110)、(111)和(220)晶面, 未出现CuO或者Cu相的衍射峰, 因此可以确定薄膜的成份为单一的Cu2O. 从XRD图谱中还可以发现, 溅射时间为5 min时, 衍射谱中仅有Cu2O(111)晶面衍射峰. 随着溅射时间的延长, Cu2O (111)晶面衍射峰相对强度逐渐减弱, 而Cu2O(110)和(220)衍射峰的强度迅速增强; 溅射30 min时, (110)和(220)晶面的衍射强度超过了(111)晶面. 可见溅射时间的增加促进了Cu2O(110)和(220)晶面的生长.
图2是不同溅射时间获得的Cu2O的光催化活性的比较, 从图中可以看出, 在实验的光强度照射下, 60 min内无催化剂时MB分子的光化学自敏化降解率为8.9%. 溅射时间为5、15和30 min得到的薄膜, 其MB降解率分别为29.4%、22.5%和12.4%.
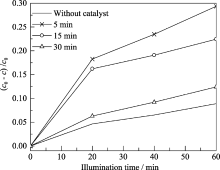 | 图2 不同溅射时间获得的Cu2O薄膜的光催化活性Fig. 2 Photocatalytic activity of Cu2O film after deposited for different time |
图3是Cu2O不同晶面表面结构的模型图, 从图中可以看出, (111)晶面表面的Cu原子有更多的悬挂键. 根据孙宝珍等[ 22]提出的氧分子在Cu2O(111)晶面的吸附模型, 本工作计算了O2在(110)和(111)晶面的吸附情况. O2吸附后的结构模型和计算结果, 分别如图4和表1所示. 从计算结果可以看出, O2在Cu2O(110)晶面的吸附能为-44.78 kJ/mol, 属于物理吸附的范畴; 而在Cu2O(111)晶面的吸附能为-157.45 kJ/mol, 属于化学吸附的范畴, 意味着O2在Cu2O(111)晶面的吸附强于在Cu2O(110)晶面的吸附, 根据光催化机理, 这种强吸附作用有利于更多的氧分子捕获表面的光生电子, 提高电子-空穴的分离效率, 从而导致各薄膜活性不同的情况.
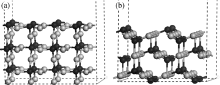 | 图3 Cu2O(110)晶面(a)和(111)晶面(b)表面结构模型图Fig. 3 Structural models for Cu2O (110) (a) and (111) (b) surfaceLight circles indicate Cu atoms, dark circles indicate O atoms |
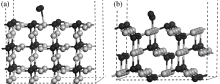 | 图4 Cu2O(110)晶面(a)和(111)晶面(b)吸附O2后的结构模型Fig. 4 Structural model for Cu2O (110) (a) and (111) (b) surface after O2 adsorptionLight circles indicate Cu atoms, dark circles indicate O atoms |
| 表1 O2在Cu2O不同晶面的吸附参数 Table 1 Adsorption parameter of O2 on different crystal planes of Cu2O |
图5为TiO2薄膜和Cu2O/TiO2复合薄膜的XRD图谱, 从图中可以看出, 经过500℃退火后的TiO2谱图中出现三个明显XRD衍射峰, 分别位于25.28°、37.85°和54.11°, 对比标准衍射峰卡片(PDF: 21-1272), 可以确定它们分别为TiO2锐钛矿(101)、(004)和(105)晶面的衍射峰. 根据Scherrer公式计算薄膜晶粒的平均大小为21.8 nm. 表面的Cu2O以(111)晶面存在, 根据Scherrer公式计算其晶粒的平均大小为12.5 nm. 从上面的计算可以得出, Cu2O (111)晶面的存在有利于复合薄膜对氧分子的吸附. 图6为TiO2和Cu2O/TiO2复合薄膜的SEM照片, 从图中可以看出, 复合薄膜Cu2O/TiO2表面的颗粒粒径小于TiO2薄膜, 这种结构特征有利于比表面积的增大和对亚甲基蓝分子和氧分子的吸附.
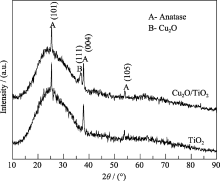 | 图5 TiO2和Cu2O/TiO2复合薄膜的XRD图谱Fig. 5 XRD patterns of TiO2 and Cu2O/TiO2 composite film Sputtering Cu2O for 6 s |
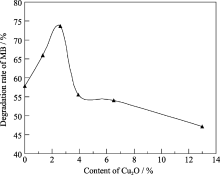
图7为Cu2O/TiO2复合薄膜中Cu2O含量对MB降解率的影响(降解时间为60 min), 从图中可以看出, 纯TiO2薄膜对MB的降解率为57.8%, 复合薄膜对MB的光催化降解率随着Cu2O含量的增加先升高后降低. 在Cu2O含量为2.6 mol% (Cu2O的溅射时间为6 s)时催化活性最好, MB降解率达到了73.6%. 这是由于Cu2O导带更负, 而氧化钛导带更正[ 11, 20], 光生电子从Cu2O的导带转移到TiO2的导带, 造成电子在TiO2晶体导带中积累; 而TiO2的价带空穴则会向表面Cu2O的价带迁移, 从而使电子-空穴对有效分离, 增强了复合薄膜的光催化效率[ 21]. Cu2O薄膜过厚时, 表面的Cu2O层内产生的光生电子离Cu2O/TiO2界面较远, 光生电子到达界面需要更长的时间, 光生电子不能发生有效的迁移. 此外, 薄膜表面光生电子迁移到界面所需要的时间越长, 电子和空穴复合的几率越大, 因此复合薄膜的光催化效率降低. 从图7中还可以看出, 当表面Cu2O含量大于6.5mol%(溅射时间大于15 s)时, 表面Cu2O薄膜太厚, 复合薄膜的催化效果和单一Cu2O薄膜的催化效果相近.
通过直流反应磁控溅射制备了Cu2O薄膜及不同厚度的Cu2O/TiO2复合薄膜, 通过XRD分析发现当反应溅射时间为5 min时, Cu2O薄膜由单一的(111)晶面组成; 反应时间的延长促进了Cu2O(110)和(220)晶面的生长. 光催化活性测试和理论计算结果表明, (111)晶面的光催化效率和对氧气分子的吸附优于(110)及(220)晶面. Cu2O/TiO2复合薄膜光催化降解MB的实验表明, Cu2O含量为2.6mol%的复合薄膜对MB的光催化降解率最好, 60 min内达到了73.6%. 过量的Cu2O会导致表面的Cu2O层内产生的光生电子离Cu2O/TiO2界面较远, 增加光生电子迁移到界面所需要的时间, 提高电子和空穴复合的几率. 当Cu2O含量大于6.5mol%时, 复合薄膜Cu2O/TiO2与单一Cu2O薄膜的活性接近.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|